Злаки содержащие глютен и продукты их переработки
Глютен что такое| чем вреден глютен для организма человека| gluten
Нейробиолог Дэвид Перлмуттер в своей книге «Еда и мозг» рассматривал связь между работой мозга и тем, что человек ест. Оказывается, пристрастие к углеводам не так невинно, способно спровоцировать такие заболевания, как слабоумие, диабет, болезнь Альцгеймера и сердечно-сосудистые нарушения.
Возникает вопрос о глютене — вреден ли он, и если да — то чем? Как влияет на организм? Какие мифы о нем существуют? Какие безглютеновые продукты следует добавить к ежедневному меню? Рассмотрим подробнее в данной статье.
Что такое глютен и в каких продуктах он есть?
Глютен — сложный белок, который содержится в ячмене, ржи, пшенице, овсе. Он обеспечивает питание зародышей культуры на стадии роста и развития. Название происходит от английского gluten (glue — клей), поэтому в народе встречается другое название — клейковина. Он не имеет цвета, запаха в сухом виде, но при соединении с водой становится похожим на серый кисель.
Глютен имеет богатый биохимический состав, включающий порядка двадцати незаменимых аминокислот, которые организм человека не способен синтезировать самостоятельно. Он довольно легко переваривается и усваивается организмом. Тем не менее, встречаются случаи аллергии, непереносимости.
Какие продукты содержат глютен? Список довольно обширный, включает:
- крупы и злаки: пшеничная, ячневая, перловая, манная, булгур, кус-кус;
- хлопья, быстрые завтраки, каши для заваривания;
- отруби;
- мука пшеничная, ржаная, причем не играет роли цельнозерновая она или нет;
- макаронные зделия;
- полуфабрикаты: колбаса, сосиски, пельмени;
- консервы;
- магазинные приправы, соусы, заправки.
Глютен является компонентом некоторых косметологических средств, кремов, препаратов. Особенно часто встречается в пудре, губной помаде. Но его количество в них крайне мало.
Рекомендуется внимательно изучать состав приобретаемых продуктов. Глютен может использоваться для связывания ингредиентов в паштетах, соках и пюре. Даже спортивное питание может содержать клейковину.
В каких еще продуктах содержится глютен?
В Интернете можно увидеть немало запросов вроде: «Есть ли глютен в киноа или нет? В зефире? В сметане?». Не всегда удается наверняка понять, имеет продукт клейковину или нет. Правило простое: продукты, в состав которых входит пшеница, ячмень, рожь, овес и производные от них содержат данное вещество. Но некоторые содержат так называемый «скрытый глютен», о котором производители не пишут на упаковках.
К таким продуктам относятся:
- лекарственные средства;
- кондитерские изделия, конфеты, мороженое;
- быстрые завтраки: хлопья, мюсли;
- полуфабрикаты, содержащие злаковые культуры;
- чипсы, картофель фри;
- алкогольные напитки: пиво, водка, коньяк;
- консервы из овощей, фруктов с добавлением крахмала на основе пшеницы;
- молочные продукты, в состав которых входят стабилизаторы;
- уксус на основе злаков;
- какао быстрого приготовления, чай с ароматическими добавками.
Список продуктов достаточно обширен. Но на каждый продукт имеется заменитель. К настоящему времени существует молоко без глютена, особые сладости, соусы. Главное — внимательно читать состав.
Таблица содержания глютена в продуктах
Следующая таблица содержит информацию о содержании клейковины, поможет больным целиакией, индивидуальной непереносимостью, аллергией составить ежедневный рацион.
| Группа продуктов | Разрешенные | Запрещенные |
|---|---|---|
| Мясо, птица, рыба | Свежее мясо, птица, рыба, морские продукты, консервы в масле, рассоле, собственном соку | Мясо в соусе с добавлением муки, пшеницы, ячменя, консервы в томатном соусе |
| Молоко | Свежее, стерилизованное, сухое, сливки, сметана, йогурт | Шоколадное молоко, йогурты со злаковыми добавками, некоторые виды молочных кремов, заправок |
| Гарниры | Картофель, рис | Макароны, спагетти, картофель-фри, каши быстрого приготовления |
| Напитки | Кофе, чай, лимонад | Пиво, крепкий алкоголь, квас |
| Овощи и фрукты | Все свежие, замороженные, приготовленные, бобы и чечевица | Приготовленные в соусе, панировке |
| Десерты | Особые без содержания клейковины, щербет, мусс, желе, джем, мед, сахар, темный и молочный шоколад | Обычные кондитерские изделия, конфеты, вафли, печенье |
На начальном этапе перехода на новое меню лучше использовать готовый рацион. Затем можно самостоятельно составлять план питания на 2-3 дня. Это позволит избежать неправильных перекусов, грамотно организовать режим питания.
Список безглютеновых продуктов
К продуктам, где нет глютена, относят:
- гороховая мука;
- льняная мука;
- бобовая мука;
- гречневая крупа;
- картофель;
- кукуруза;
- курага;
- финики;
- чернослив;
- мед;
- сахар;
- молочные продукты;
- рыба;
- вареное мясо;
- арахис;
- грецкий орех;
- миндаль;
- ягоды;
- куриные яйца.
Из продуктов без глютена можно составить полноценное меню, богатое питательными веществами, витаминами, минералами.
Чем вреден глютен?
Вред глютена для организма объясняется его воздействием на системы организма, внутренние органы:
- Вреден для пищеварения. Попадая в пищеварительную систему, он проходит вместе с пищей через желудок, оказывается в тонкой кишке. Именно здесь начинается негативное воздействие. Сложный белок вызывает раздражение, ухудшает всасывание питательных компонентов, работу ворсинок, покрывающих стенки тонкого кишечника.
- Иммунная система не может распознать данный вид белка, выделяет антитела для его уничтожения. Он, в свою очередь, очень похож по строению на клетки щитовидной железы, ткани сердечно-сосудистой системы. Получается, что вместе с глютеном уничтожаются похожие ткани и клетки. Как следствие, развиваются такие болезни как зоб Хашимото, диабет первого типа, рассеянный склероз.
- Иммунная атака приводит к разрушению клеток кишечника, нарушению работы пищеварения. Возможно возникновение следующих проблем: метеоризм, запоры, диарея, аллергия.
- Особенный вред для организма глютен приносит после 40 лет. Тело перестраивается, происходит смена работы многих систем. В результате он перестает усваиваться, клейковина оседает на стенках кишечника, лишает его возможности активно всасывать питательные вещества.
Даже здоровым людям следует внимательно изучить вопрос о том, чем опасен глютен для здоровья человека. Это позволит предупредить многие заболевания, вовремя перейти на правильное, здоровое питание.
Аллергия на глютен
Аллергия на глютен встречается довольно редко. Вызвана она следующими факторами:
- Снижение иммунитета.
- Нарушение работы желудка, желудочно-кишечного тракта.
- Негативное влияние внешних факторов: вирусы, инфекции, окружающая среда, образ жизни.
Аллергия на глютен определяется по следующим показателям анализов: повышение щелочной фосфатастазы, низкий холестерин, высокий альбумин. Такие показатели характерны для наличия различного рода патологий в печени, почках, нарушений костной, мышечной ткани. У больного развивается стоматит, артрит, что свидетельствует о воспалении внутренних органов. Непереносимость такого типа белка отрицательно влияет на мозг — нарушается его кровообращение. В результате диагностируется мигрень, неврология. Человек замечает ухудшение самочувствия, возникает усталость и недомогание, развивается депрессия.
Важно понимать, что польза и вред глютена — вопросы, которые следует обсуждать только с экспертами. Неспроста у отечественных специалистов по снижению веса имеется целый ряд разработок правильного питания, куда включены только продукты без клейковины.
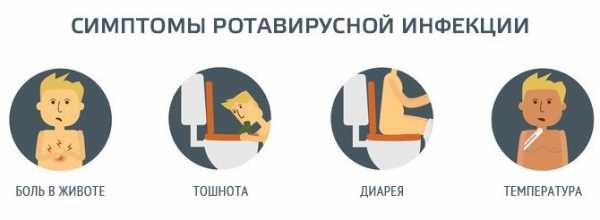
Симптомы непереносимости глютена
У людей, больных целиакией, первые симптомы появляются в младенческом возрасте. Обычно после введения в прикорм манной каши в 6-8 месяцев. Но бывают случаи, когда непереносимость глютена проявляется позже. Нередко это вызвано сильным инфекционным заболеванием — кишечной инфекцией, ОРВИ.
Существуют типичные признаки непереносимости клейковины. К ним относят:
- обильный стул сероватого оттенка, напоминающий по консистенции кашу;
- стремительное снижение веса;
- периодическое увеличение окружности живота, вздутие;
- возможно отставание в психомоторном развитии.
Симптомы могут проявляться вместе или по отдельности. Они очень схожи с симптоматикой ряда других заболеваний. Данный факт сказывается на диагностике, затрудняет ее.
Непереносимость клейковины сопровождается вторичными нарушениями обмена веществ. Глютен влияет на желудочно-кишечный тракт, иммунную систему, нарушая их работу. Как следствие:
- Ухудшается всасывание витаминов, питательных веществ. Особенно плохо усваиваются кальций, витамин D, что приводит к появлению таких заболеваний как остеопороз, рахитоподобная деформация костей.
- Ухудшается липидный и углеводный обмены. Это может привести к нарушениям энергетического обмена, полигиповитаминозу.
- Возможно появление лактозной недостаточности, сопровождающейся вздутием живота, обильным стулом, имеющим кислый запах, пенистую консистенцию.
Влияние глютена для человека может быть опасным, если имеется аллергия, индивидуальная непереносимость. Но установить это, назначить соответствующее лечение, питание способен только специалист.
Для худеющих с индивидуальной непереносимостью глютена специалисты по снижению веса также готовы предложить особый рацион. Он учитывает наличие аллергии, при этом снабжает организм необходимыми питательными веществами, витаминами, минералами.
Что такое целиакия?
Целиакия — наследственное аутоиммунное заболевание, при котором наблюдается атрофия слизистых оболочек тонкой кишки вследствие непереносимости глютена и близких к нему белков растительных культур. Современные исследования ученых показали, что ген, который отвечает за наличие предрасположенности к целиакии имеется примерно у 1% населения планеты.
Непереносимость клейковины может стать причиной других серьезных заболеваний, одно из которых — атерогенный метаболический дисбаланс. Это тип ожирения, при котором жировые отложения скапливаются в районе живота, брюшной полости, концентрируются вокруг жизненно важных органов. У таких людей наблюдаются одышка, головокружения, слабость, вызванные гипоксией, неправильной работой внутренних органов.
Другое заболевание, вызванное непереносимостью — глютеновое ожирение. В данном случае жировые отложения концентрируются в районе бедер. Особенно часто встречается у женщин после менопаузы, климакса.
Для решения этих проблем лучше обратиться к специалисту. Профессионалам известно, что медикаментозное лечение здесь бессмысленно. Быстро и надёжно работает только комплексная методика, включающая в себя изменение не только рациона и пищевых привычек, но и психоэмоционального состояния. Для этого человеку важно «принять» свою болезнь и научиться жить без нежелательных продуктов.
Способ диагностики непереносимости глютена
Симптоматика данного заболевания схожа со многими другими болезнями. Поэтому для постановки верного диагноза потребуется пройти комплексное клиническое исследование: анамнез, эндоскопические и гистологические исследования слизистых оболочек тонкой кишки, анализ крови на выявление АГА — андрогенетической алопеции.
В качестве дополнительных исследований могут быть назначены:
- липидограмма кала. Она отражает поражение поджелудочной железы вследствие нарушения работы желудочно-кишечного тракта;
- ксилозный тест, позволяющий оценить, насколько нарушена система всасывания моносахаридов;
- определение количества углеводов в кале, позволяющее оценить степень лактозной недостаточности.
Главное — своевременное обращение к профессионалам, врачам высокой квалификации.
Сколько процентов населения действительно могут пострадать от глютена?
Как уже было сказано, целиакия — аутоимунное заболевание, встречающееся у 1% людей (один человек из ста страдает от непереносимости глютена). Она имеет различные формы, не всегда может быть диагностирована. Примерно у 6% людей наблюдается повышенная чувствительность к клейковине. При таком отклонении нет целиакии, но имеются некоторые симптомы.
Особенно часто целиакия встречается у новорожденных детей. Педиатры умело его определяют на ранних этапах развития по следующим симптомам: запор или диарея, задержка роста, развития, снижение гемоглобина, альбумина.
Целиакия не лечится посредством лекарственных препаратов. Единственный выход — еда без глютена, особый рацион, план питания. При этом нет смысла придерживаться диеты частично — необходимо кардинально менять пищевые привычки. Помочь справиться с лишениями, перейти к новой, здоровой жизни способен грамотный психолог.
Непереносимость глютена у здоровых людей
Даже у здорового человека может наблюдаться симптоматика целиакии в определенной степени:
- Возникновение проблем с желудочно-кишечным трактом.
- Изменение веса без объективных причин.
- Дисбаланс гормонов: нарушение менструального цикла, сильный предменструальный синдром, нарушение сна.
- Расстройства центральной нервной системы: нарушение концентрации, внимания, депрессивное состояние, усталость, беспокойство.
- Возникновение проблем с кожей, ногтями: кератоз, дерматит, зуд, высыпания.
- Синдром гиперактивности, дефицита внимания.
- Ухудшение состояния зубов.
Как уже было сказано, симптоматика непереносимости глютена схожа со многими другими заболеваниями. Поэтому лучше перестраховаться, обратиться к врачам и выяснить истинные причины появления данных симптомов.
Чем здоровому человеку грозит отказ от глютена?
Если у человека нет явной непереносимости, серьезных проблем со здоровьем, то добавлять небольшое количество продуктов с клейковиной можно, даже нужно:
- лизин, содержащийся в глютене, необходим иммунной системе для регенерации тканей, обеспечения защитных функций, противостояния вирусам, инфекциям;
- треонин участвует в пищеварительных процессах, нормализует работу желудка, желудочно-кишечного тракта;
- метионин активно участвует в метаболических процессах.
Перечисленные вещества — незаменимые аминокислоты. Организм не способен синтезировать их самостоятельно. Один из способов восполнить дефицит — получить их из пищи.
Какие мифы окружают глютен?
О глютене ходит немало мифов. Наиболее популярные следующие:
- Непереносимость клейковины — распространенное заболевание, встречающееся у многих. Было сказано, что от целиакии страдает лишь 1%. Еще 6% имеют симптоматику, проявляющуюся в различной степени.
- Глютен — главная причина появления метеоризма. Обычно газообразование у людей наблюдается после употребления хлебобулочных изделий.
- Но это нормально: при расщеплении дрожжей, содержащихся в выпечке, происходит процесс брожения, сопровождающийся выделением газа.
- Вреден для фигуры, ведет к ожирению. Всё зависит не от клейковины, а от калорийности блюд.
- Непереносимость клейковины — следствие неправильного питания. Это не так. Целиакия — генетическое заболевание.
Польза и вред глютена примерно одинаковы. Это продукт, который подходит не всем, требует ограничения порций. Но выбор конкретного типа питания, ограничение определенных продуктов — задача специалистов, решать такие вопросы самостоятельно не рекомендуется.
продуктов без глютена | Фонд по борьбе с глютеновой болезнью
Многие продукты, которые обычно содержат глютен, имеют безглютеновые альтернативы, которые широко доступны в большинстве продуктовых магазинов и делают жизнь без глютена намного проще. Однако имейте в виду, что минимально обработанные свежие продукты являются важной частью здоровой безглютеновой диеты. Очень важно строить свой рацион на фруктах, овощах, мясе и других группах здорового питания, перечисленных выше.
Многие коммерчески доступные продукты помечены как «безглютеновые», но есть и другие продукты; вот почему так важно правильно читать этикетки.Также важно помнить, что «без пшеницы» не обязательно означает «без глютена». Будьте осторожны, так как многие продукты могут показаться безглютеновыми, но это не так.
Как правило, традиционные продукты из пшеницы, такие как макаронные изделия, хлеб, крекеры и другие хлебобулочные изделия, не содержат глютен. Однако существует множество вариантов без глютена, в которых используются альтернативные виды муки и зерна. Часто хлеб без глютена можно найти в морозильной камере . Кроме того, в продуктовых рядах есть мука без глютена и мучные смеси, позволяющие испечь хлеб самостоятельно.
.Глютен в зернах | Совет по питанию зерновых и бобовых
Глютен происходит от латинского слова «клей», которое придает тесту эластичное свойство, удерживающее газ, когда оно поднимается. Пузырьки углекислого газа выделяются из ферментирующих дрожжей, которые захватываются вязкоупругим белком, обеспечивая легкую сотовую структуру теста. Эластичная природа клейковины также удерживает вместе частицы теста, предотвращая крошку во время раскатывания и формования. Следовательно, глютен играет жизненно важную роль в производстве закваски.
Глютен - это название, данное белку, который содержится в некоторых, но не во всех зернах:
- Зерна, содержащие глютен - пшеница (включая такие сорта пшеницы, как полба, камут, фарро и твердые сорта, а также такие продукты, как болгарский перец и манная крупа), ячмень, рожь, тритикале и овес *
- Зерна без глютена - кукуруза, просо, рис, сорго.
- Псевдозлаки без глютена - амарант, гречка, киноа.
* Овес и целиакия
«Каждый пятый человек с глютеновой болезнью реагирует на овес.Celiac Australia рекомендует не есть овес людям с глютеновой болезнью, если у них не была проведена биопсия, чтобы убедиться, что они не реагируют на овес ». Источник: Celiac Australia .
Глютен - это название, данное белку пшеницы, ржи, ячменя и овса, который поражает людей с глютеновой болезнью. Это составное название, поэтому глютен означает:
- Глиадин в пшенице
- Ордеин в ячмене
- Секалин во ржи
- Авенин в овсе
Текущие тесты на глютен могут измерять глиадин, гордеин и секалин, но не авенин, поскольку это немного другой белок.Соответственно, Кодекс пищевых стандартов Австралии и Новой Зеландии запрещает использовать овес в пищевых продуктах, маркированных или рекламируемых как не содержащие глютен. Когда люди обсуждают овес без глютена (а лаборатории говорят, что овес не содержит глютена), следует сказать, что он не содержит глиадина пшеницы (и ржи, ячменя), то есть нет измеримого загрязнения.
Авенин является неотъемлемой частью овса (как глиадин с пшеницей). Овес никогда не будет свободным от глютена (т. Е. Авенина) [даже если он описан как глютен (т.е.е. глиадин) бесплатно]. Как неоднократно упоминалось в австралийском журнале Celiac, доктор Роберт Андерсон обнаружил, что примерно 1: 5 людей с глютеновой болезнью реагируют на чистый незагрязненный овес, то есть они реагируют на овсяный авенин.
Поскольку мы не можем определить, кто такое 1: 5, и знаем, что повреждение может произойти при отсутствии симптомов, доктор Андерсон советует (и Celiac Australia) не употреблять овес без биопсии до и во время употребления.
Этикетки для пищевых продуктов
Кодекс пищевых стандартов Австралии и Новой Зеландии требует наличия злаков, содержащих глютен (т.е. пшеница, рожь, ячмень, овес и полба и их гибридные штаммы) в розничных и упакованных пищевых продуктах указано на этикетке. Некоторые производители продуктов питания используют полужирный шрифт для выделения всех злаков, содержащих глютен, в списке ингредиентов, чтобы гарантировать, что обязательная декларация всех ингредиентов глютена отличается от других перечисленных веществ.
Если продукт не требует наличия этикетки (например, хлеб, продаваемый в пекарне), присутствие глютеносодержащих ингредиентов должно быть заявлено на или в связи с выставкой продукта на витрине или заявлено покупателю по запросу.
.Frontiers | Что такое глютен? Почему он особенный?
Введение
Пшеничный глютен был одним из первых белков, которые стали предметом научных исследований Якопо Беккари (профессор химии Болонского университета) в его статье «De Frumento» (О зерне) 1745 года (1, 2). С тех пор он был детально изучен химиками-зерновыми из-за его роли в создании квасного хлеба, других хлебобулочных изделий, макаронных изделий и лапши. Эти свойства лишь в очень ограниченной степени присущи родственным злакам (ячменю и ржи).Следовательно, глютен лежит в основе производства основных продуктов питания для значительной части населения мира, особенно в зонах с умеренным климатом.
Хотя глютен был определен как триггер целиакии почти 70 лет назад (3), интерес к глютену за пределами научного сообщества был ограничен лишь теми, кому не посчастливилось страдать от целиакии до начала нынешнего века, когда наблюдался взрывной рост интерес, особенно в популярной прессе и социальных сетях. Например, поиск в Google, выполненный в декабре 2018 года, дал почти 400 миллионов обращений менее чем за минуту.Этот интерес, конечно, связан с предполагаемой ролью глютена в запуске ряда побочных реакций, при этом значительная часть населения во многих странах предпочитает безглютеновую диету или диету с низким содержанием глютена. Однако, несмотря на такой массовый интерес, мало кто имеет четкое представление о самом глютене: что это такое, каково происхождение, почему он особенный?
Эта статья, которая является частью специальной исследовательской темы «Глютен от растения к тарелке: последствия для людей с глютеновой болезнью», поэтому дает широкий обзор глютена пшеницы, включая его синтез и отложение в развивающемся зерне, структурах и т.д. и эволюционные отношения входящих в его состав белков, и его уникальные свойства, которые используются при переработке зерна, с упором на особенности, которые имеют отношение к его роли в запуске целиакии.Он не охватывает другие воздействия белков пшеницы на здоровье человека, в частности аллергию и нечувствительность к глютену без глютена (NCGS), которые обсуждаются в других недавних обзорных статьях (4, 5).
Что такое глютен?
Глютен определяется на основе его происхождения и растворимости
Клейковина классически определяется как в значительной степени белковая масса, которая остается, когда тесто, приготовленное из пшеничной муки и воды, осторожно промывается в избытке воды или разбавленного раствора соли для удаления большей части крахмала и растворимого материала (6).Оставшийся материал, который был описан как «каучукоподобный», содержит около 75–80% белка в пересчете на сухое вещество, в зависимости от того, насколько хорошо материал промыт. Следовательно, «белки глютена» определяются как те, которые присутствуют в этой массе, и, поскольку аналогичный материал нельзя выделить из теста, приготовленного из муки других злаков, белки глютена ограничены зерном пшеницы (виды рода Triticum ). Однако родственные белки присутствуют в других злаках (как обсуждается ниже), и в неспециализированной литературе и в более широких популярных средах они часто называются глютеном.
Точнее, глютен и родственные ему белки из других злаков классифицируются как «проламины». Это название было придумано Т. Осборн, отец химии растительных белков, работал на сельскохозяйственной экспериментальной станции Коннектикута с 1886 по 1928 год. За этот период он опубликовал около 250 статей, в том числе исследования белков семян 32 видов. Это позволило ему разработать широкую классификацию белков на основе их экстракции в ряде растворителей (7). Эта экстракция часто выполняется последовательно (и называется «фракционированием Осборна») с четырьмя фракциями Осборна, называемыми альбуминами (растворимыми в воде), глобулинами (растворимыми в разбавленном солевом растворе), проламинами (растворимыми в 60–70% спирте) и глютелинами ( не растворим в других растворителях, но может экстрагироваться щелочью).Первые две фракции легко различить, и названия все еще используются, в то время как проламины были признаны как определенная группа, присутствующая только в зерновых культурах, и название основано на их высоком содержании пролина и амидного азота (теперь известно, что они производятся из глютамина). ). Этой фракции даны особые названия у разных видов злаков: глиадин в пшенице, гордеин в ячмене, секалин в ржи, зеин в кукурузе и т. Д.
Однако конечную фракцию (глютелин) определить труднее, поскольку она фактически включает все белки, которые нерастворимы в трех предыдущих растворителях, но могут солюбилизироваться в условиях экстремального pH.Фактически, теперь известно, что глютелины включают смесь неродственных белков, включая нерастворимые структурные и метаболические белки, такие как те, которые связаны с мембранами и клеточными стенками. Однако эти белки присутствуют только в небольших количествах, и в пшенице (и большинстве других зерновых) основными компонентами глютелина являются субъединицы проламина, которые не экстрагируются смесями спирт / вода из-за их присутствия в виде высокомолекулярных полимеров, стабилизированных межцепочечными связями. дисульфидные связи. В пшенице эти белки называются глютенином и присутствуют примерно в равных количествах с растворимыми в спирте глиадинами, две группы которых включают глютен.
Белки глютена - основная фракция белков хранения
Белки глютена - это основная группа белков, которые хранятся в зерне для поддержки прорастания и развития проростков. Они ограничены в распространении крахмалистыми клетками эндосперма зерна и не были обнаружены ни в каких других тканях зерна или растения. Их путь и механизмы синтеза и отложения были подробно изучены [см. Tosi (8)], но здесь особенно важны два момента.Во-первых, они изначально откладываются в дискретных белковых телах, которые сливаются на более поздних стадиях развития зерна, образуя непрерывную матрицу, окружающую гранулы крахмала (рис. 1А). Эта матрица образует непрерывную белковую сеть внутри клетки, что может быть обнаружено, когда крахмал удаляется из частицы муки путем ферментного переваривания (рис. 1В). Легко представить, как белковые сети, присутствующие в отдельных клетках, могут быть объединены во время замеса теста, чтобы сформировать непрерывную сеть клейковины в тесте.
Рисунок 1 . Происхождение пшеничной клейковины. (A) Просвечивающая электронная микроскопия крахмалистых клеток эндосперма на поздней стадии развития зерна (46 дней после цветения) показывает, что отдельные белковые тела слились, образуя непрерывный белковый матрикс. Взято из Shewry et al. (9) с разрешения, предоставленного доктором М. Паркером (IFR, Норвич, Великобритания). (B) При переваривании частицы муки с целью удаления крахмала обнаруживается непрерывная белковая сеть.Взято у Amend и Beauvais (10) с разрешения. (C) Поперечный срез области долей развивающегося зерна пшеницы, окрашенный толуидиновым синим, чтобы показать структуру ткани и отложенный белок (синим цветом). Рисунок любезно предоставлен Кристиной Санчис Гритч и Паолой Този (Rothamsted Research).
Второй важный момент заключается в том, что белки глютена неравномерно распределены в крахмалистых клетках эндосперма, но обогащены внешними 2–3 слоями клеток (которые называются субалейроновыми клетками).Это проиллюстрировано на рис. 1С, на котором показан участок крахмалистых клеток эндосперма и наружных слоев доли зерна на поздней стадии развития, окрашенных толуидиновым синим, чтобы показать белок. Фактически, Кент (11) подсчитал, что содержание белка в клетках крахмалистого эндосперма варьируется более чем в 4 раза, от 45% в субалейроновых клетках до 8% в центральной области. Кроме того, состав белка глютена также варьируется: процент высокомолекулярных субъединиц глютенина (HMW-субъединицы) увеличивается, а доля низкомолекулярных (LMW) субъединиц и глиадинов (кроме ω-глиадинов) уменьшается (эти типы белков обсуждаются. ниже) (12).Эти градиенты в составе в некоторой степени отражаются на содержании и составе белков глютена в потоках муки, производимых коммерческой вальцовой мельницей, а это означает, что эти фракции также могут различаться по своему влиянию на здоровье (13).
Последствия целиакии
Фракционирование путем обычного измельчения в сочетании с измельчением (истирание) или шелушением (трение) может привести к потокам муки, которые обогащены или обеднены глютен-активными белками. Использование жизненно важного глютена (который коммерчески производится для обогащения пищевых продуктов) также имеет значение.Он будет содержать все белки глютена, присутствующие в муке происхождения, но также может содержать другие биологически активные белки в качестве «попутчиков».
Белки глютена
Глютен включает несколько родственных семейств белков, кодируемых мультигенными семействами
Фракция белка глютена состоит из сложной смеси компонентов, которые можно разделить на группы с помощью электрофореза. Электрофорез глиадинов при низком pH разделяет четыре группы полос, называемых (с точки зрения уменьшения подвижности) α-глиадинами, β-глиадинами, γ-глиадинами и ω-глиадинами.Однако сравнение аминокислотных последовательностей показывает, что α- и β-глиадины образуют единую группу, иногда называемую глиадинами α-типа.
Полимеры глютенина слишком велики, чтобы их можно было разделить обычным электрофорезом, но уменьшение межцепочечных дисульфидных связей, которые стабилизируют полимеры, позволяет разделить субъединицы электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) на две группы полос, назвали субъединицы HMW и LMW. Последняя группа может быть далее подразделена на основную группу компонентов (субъединицы LMW B-типа) и две второстепенные группы (C-тип и D-тип).
Сравнение аминокислотных последовательностей этих групп компонентов белка глютена проясняет их взаимоотношения, показывая, что субъединицы HMW и ω-глиадины образуют дискретные группы, а α-глиадины, γ-глиадины и субъединицы LMW B-типа образуют третью группу. . Минорные группы субъединиц LMW C-типа и D-типа, по-видимому, являются модифицированными формами глиадинов, в которых мутации с образованием остатков цистеина позволяют их включать в полимеры глютенина, при этом субъединицы LMW C-типа являются модифицированными α-глиадинами или γ-глиадинами. и модифицированные ω-глиадины D-типа.Эта классификация обобщена в таблице 1, в которой также показаны их относительные количества и обобщены их характеристики (молекулярные массы и частичный аминокислотный состав).
Таблица 1 . Резюме типов и характеристик белков пшеничного глютена [на основе Shewry and Halford (14)].
Таблица 1 также группирует типы белков глютена, обсужденные выше, в три «семейства» (HMW, проламины с высоким содержанием серы (S) и с низким содержанием S), которые были определены около 30 лет назад на основе новых данных о последовательности (15). .Эта классификация остается в силе, несмотря на огромный рост наших знаний о последовательностях белка глютена за последние несколько десятилетий. Например, в мае 2015 года Bromilow et al. (16) получили более 24000 последовательностей, связанных с белками глютена, из базы данных UniProt. Удаление повторяющихся, частичных и неправильно назначенных последовательностей позволило собрать тщательно подобранную базу данных из 630 последовательностей.
Получение более 600 последовательностей белков глютена, конечно, не означает, что отдельные генотипы пшеницы содержат такое количество белков глютена.Хотя точное количество белков глютена, присутствующих в зрелых семенах, не было определено, исследование двумерного (2D) электрофоретического разделения показывает, что количество белков глютена, присутствующих в определяемых количествах, вероятно, составляет от 50 до 100. Это согласуется с недавними исследование Bromilow et al. (17), которые идентифицировали 63 белка глютена в одном сорте, используя масс-спектрометрию и тщательно подобранную базу данных последовательностей (16). Однако это исследование выявило восемь индивидуальных белков субъединиц HMW, что вдвое превышает количество, которое, как известно, присутствует в исследуемом сорте.Это подчеркивает проблемы, присущие идентификации белков глютена на основе коротких пептидных последовательностей.
Хотя группы проламина, обсужденные выше, несомненно, составляют подавляющее большинство белков глютена, недавняя работа показала, что присутствуют небольшие количества другого типа белка глютена. Они были определены как δ-глиадины, хотя сравнение последовательностей показывает, что они составляют часть более широкого семейства γ-проламинов (наиболее близких по последовательности к γ3-гордеинам ячменя) (18, 19).Протеомный анализ показывает, что они составляют 1,2% от общего нормализованного объема пятен в зерне яровой пшеницы китайской (20).
Молекулярная основа полиморфизма белка глютена
Большое количество отдельных белков глютена, присутствующих в единичных генотипах, и 10-кратное большее количество последовательностей в базах данных обусловлено тремя факторами: наличием мультигенных семейств, высоким уровнем полиморфизма между генотипами и, в более ограниченной степени, , посттрансляционная модификация.Следовательно, необходимо учитывать эти факторы по очереди.
Мягкая пшеница ( Triticum aestivum ), которая включает современную мягкую пшеницу и полбу, представляет собой гексаплоидный вид с тремя геномами (называемыми A, B и D), полученными из родственных диких трав. Только два из этих геномов (A и B) присутствуют в тетраплоидных твердых (макаронных) продуктах пшеницы и emmer (формы Triticum turgidum ), тогда как эйнкорн ( Triticum monococcum ) является диплоидным с геномом только A. Белки глютена кодируются локусами на хромосомах группы 1 и группы 6 всех трех геномов, а это означает, что можно ожидать, что фракция глютена будет содержать больше индивидуальных белковых компонентов в мягкой пшенице, чем в других видах.Подробное обсуждение генетики белков глютена выходит за рамки этой статьи, но читатель может обратиться к Shewry et al. (21) для подробного описания.
Кроме того, все локусы белка глютена содержат несколько генов. Простейшие локусы - это локусы Glu-1 , которые расположены на длинных плечах хромосом группы 1. Каждый из этих локусов содержит два гена, которые кодируют два типа HMW-субъединицы глютенина (называемые x-типом и y-типом). Однако, поскольку не все гены Glu-1 экспрессируются во всех генотипах, количество белков субъединицы HMW у сортов мягкой пшеницы варьирует от 3 до 5 (22).Благодаря простой генетической системе и тому факту, что субъединицы HMW были изучены более подробно, чем большинство групп белков глютена, можно определить аллели во всех трех локусах. Таким образом, широко распространенные пары субъединиц, называемые 1Dx2 + 1Dy12 и 1Dx5 + 1Dy10, являются аллелями, тогда как пары субъединиц, называемые 1Dx2 + 1Dy12 и 1Bx7 + 1By9, являются гомеоаллелями (аллелями в разных геномах). Большая сложность других локусов белка глютена значительно затрудняет распознавание аллельных форм генов и белков, хотя сообщалось о подробном анализе аллельных вариаций в субъединицах LMW [обзор Juhász et al.(23)].
Однако, в то время как отдельные субъединицы HMW могут быть отнесены к секвенированным генам, это очень сложно, если не невозможно, для многих других белков глютена из-за сложности локусов. Например, Huo et al. (19) собранные последовательности локусов α-глиадина в трех геномах мягкой пшеницы, показывающие в общей сложности 47 генов, 26 из которых кодируют интактные полноразмерные белковые продукты. Аналогичным образом Qi et al. (24) сообщили о последовательностях 29 предположительно функциональных генов γ-глиадина (кодируемых генами Gli-1 локусов на коротких плечах хромосом группы 1) в одном сорте.Дополнительную информацию о структурах мультигенных локусов белка глютена дает анализ генома [см., Например, (5, 25, 26)].
Также вероятно, что количество экспрессируемых генов варьируется в зависимости от генотипа. Таким образом, высокий полиморфизм в составе белка глютена, наблюдаемый между генотипами, может возникать как из-за вариации количества экспрессируемых генов, так и из-за вариации в последовательностях кодируемых белков.
Третьим фактором, который может способствовать полиморфизму белка, является посттрансляционная модификация.Белки глютена содержат от 20 до 50 мол.% Остатков глутамина, поэтому посттрансляционное дезамидирование уже давно признано возможным. Это может, например, объяснить тот факт, что субъединицы HMW часто образуют «цепочки» пятен при 2D-электрофорезе, тогда как Dupont et al. (27) сообщили о наличии последовательностей субъединиц HMW в 43 пятнах, разделенных на 2D-гелях. Однако степень дезамидирования никогда не оценивалась. Другие предложенные модификации, такие как гликозилирование (28) и фосфорилирование (29), не были подтверждены дальнейшими исследованиями.Другие типы посттрансляционной модификации могут включать циклизацию N-концевого глутамина с образованием пироглутамата (который, вероятно, отвечает за многие белки глютена, имеющие «заблокированные» N-концы), дифференциальный процессинг сигнального пептида (30) и протеолиз за счет легумаиноподобная аспарагинилэндопротеиназа (31).
Наконец, пропорции белков глютена также могут зависеть от окружающей среды, включая температуру во время развития зерна и доступность питательных веществ (азота и серы) [обзор DuPont и Altenbach (32) и Altenbach (33)].В частности, увеличение доли глиадинов происходит при высокой доступности азота и ω-глиадинов, когда доступность азота высока, но содержание серы ограничено.
Последствия целиакии
Полиморфизм белка, несомненно, является проблемой для попыток устранить «токсичные» белки и вывести пшеницу, безопасную для глютеновой болезни, будь то использование естественных вариаций или генная инженерия / редактирование генома.
Влияние окружающей среды на белковый состав глютена также окажет влияние на количество конкретных эпитопов целиакии.
Белки глютена содержат уникальные повторяющиеся домены
Наиболее важной характеристикой белков глютена пшеницы в связи с их ролью при глютеновой болезни является наличие белковых доменов, содержащих повторяющиеся последовательности. Домены различаются по протяженности, но обычно составляют от 30 до 50% последовательности белка в S-богатых глиадинах и субъединицах LMW, от 75 до 85% в субъединицах HMW и почти весь белок в ω-глиадинах [обзор Shewry et al. (34)].Они содержат тандемные повторы коротких пептидов, содержащих от трех до девяти аминокислотных остатков, и могут быть основаны на тандемных повторах одного мотива или тандема и чередующихся повторах двух или более мотивов.
Наиболее широко изучаемые повторяющиеся последовательности присутствуют в HMW-субъединицах глютенина. Они включают повторы на основе трех мотивов: гексапептида PGQGQQ, нонапептида GYYPTSPQQ или GYYPTSLQQ и только в субъединицах x-типа трипептид GQQ (P, пролин; G, глицин; Q, глутамин, Y, тирозин; P, пролин; Т - треонин, S - серин; L - лейцин) (34).Мотивы, присутствующие в других группах белков глютена, как правило, менее консервативны, и идентификация консенсусных мотивов более субъективна, чем в субъединицах HMW, но все они богаты пролином и глутамином, например, PQQPFPQQ (F, фенилаланин) в γ-глиадинах. Следует отметить, что эти последовательности ответственны за характерный аминокислотный состав целых белков, особенно за высокое содержание глутамина (35–55 мол.%) И пролина (10–25 мол.%) Во всех группах проламинов, высокое содержание глицина. в субъединицах HMW (11–12 мол.%) и с высоким содержанием фенилаланина (около 11 мол.%) в ω-глиадинах [обзор Shewry et al.(34)].
Повторяющиеся последовательности также могут быть ответственны за необычные свойства растворимости белков глютена. Хотя глутамин является гидрофильной аминокислотой, считается, что регулярно повторяющиеся остатки глутамина в белках глютена образуют водородные связи белок: белок, приводящие к нерастворимости в воде (как обсуждалось Белтоном (35) для субъединиц HMW). Однако в большинстве белков глютена все остатки цистеина, которые могут образовывать межцепочечные или внутрицепочечные дисульфидные связи, расположены в неповторяющихся доменах.
Повторяющиеся последовательности также играют решающую роль в запуске целиакии. Фактически, все из 31 «релевантных Т-клеточных эпитопов целиакии», перечисленных Sollid et al. (36) присутствуют в повторяющихся доменах пшеницы или родственных злаков (ячмень, овес, рожь), и все группы белков глютена (глиадины и глютенины) содержат эпитопы. Тем не менее, некоторые отдельные белки в этих группах могут не иметь распознаваемых эпитопов целиакии (хотя текущий список эпитопов считается неполным).Это проиллюстрировано на Рисунке 2 (37) и подробно обсуждено Shewry и Tatham (37), Gilissen et al. (38) и Juhasz et al. (5).
Рисунок 2 . Распределение Т-клеточных эпитопов (показано красными столбиками) в репрезентативных белках глютена пшеницы (идентифицированных кодами доступа GenBank). Эпитопы основаны на Sollid et al. (36). α -глиадин P18573: DQ2.5-глия-α1a, DQ2.5-глия-α1b, DQ2.5-глия-α2 и DQ8-глия-α1. γ-глиадин AAK84774: DQ2.5-глия-ω1 / гор-1 / сек-1, DQ8-глия-γ1a, DQ8-глия-γ2, DQ8-глия-γ4c и DQ8-глия-γ5.ω-глиадин (A / D) AAT74547: DQ2.5-глия-γ5, DQ8-глия-γ1a, DQ2.5-глия-ω1 / гор-1 / сек-1, DQ8-глия-γ1b и DQ2.5 -глиа- γ3. ω-глиадин (B) AB181300 не содержит токсических эпитопов целиакии. Субъединица LMW AAS66085: DQ2.5-glut-L1. Субъединица HMW (1Bx17) BAE96560: DQ8.5-glut-h2. Субъединица HMW (1Dy10) AAU04841: DQ8.5-glut-h2. Изменено Шури и Татхамом (37).
Последствия целиакии
Как обсуждалось выше, все эпитопы, токсичные для глютеновой болезни в белках глютена пшеницы, присутствуют в повторяющихся последовательностях с множественными эпитопами, присутствующими в некоторых повторяющихся доменах.Это явно представляет собой серьезную проблему для попыток «удалить» эпитопы с помощью трансгенеза или редактирования генов.
Надсемейство проламинов
Проламины, включая белки глютена пшеницы, исторически определялись как уникальный класс белков, ограниченных зерном злаковых и родственных видов трав, на основании их необычного аминокислотного состава и свойств растворимости (7), и эта догма не подвергалась сомнению до тех пор, пока увеличение доступности данных о последовательностях белков позволило сделать более широкие сравнения.Первое сообщение о том, что проламины связаны с более широким спектром белков, было сделано в 1985 году, когда Kreis et al. (39) показали, что последовательности, присутствующие в богатых цистеином неповторяющихся областях проламинов, были связаны с последовательностями в двух других группах белков семян: ингибиторы α-амилазы и трипсина зерновых (теперь называемые ATI) и запасные белки 2S альбумина двудольных растений. семена. Хотя эти группы белков имеют небольшую идентичность последовательностей друг с другом или с проламинами, гомология основана на очень высокой сохранности числа и расстояния между остатками цистеина.Дальнейшие сравнения с использованием значительного увеличения данных о последовательностях с тех пор выявили несколько других групп родственных белков, которые вместе называются «суперсемейством проламинов».
Суперсемейство проламинов включает белки, которые не ограничиваются злаками и травами и присутствуют в тканях, отличных от семян (40). Однако в зерне пшеницы присутствует несколько типов, которые могут влиять на функциональные свойства и роль в питании и здоровье (34). Поэтому они кратко обсуждаются здесь и сведены в Таблицу 2.
Таблица 2 . Белки зерна пшеницы суперсемейства проламинов (на основе литературы, обсуждаемой в тексте).
Фаринины и пуринины
В течение многих лет было известно, что пшеничная мука содержит белки с молекулярной массой ниже 30 кДа, которые связаны с белками глютена, включая типы, описанные как глобулины, низкомолекулярные глиадины и авениноподобные белки. Kasarda et al. (41) недавно обсудили взаимосвязь этих белков и предложили разделить их на два типа, которые они назвали фарининами и пурининами.Оба более тесно связаны с глиадинами, чем другие типы белков, обсуждаемые ниже, но не имеют повторяющихся последовательностей, типичных для глиадинов. Следовательно, они были классифицированы как глобулины на основе растворимости. Фаринины соответствуют авениноподобным белкам (определенным на основе гомологии с белками авенинов овса) двух типов, называемых a (которые соответствуют LMW глиадинам) и b (42). Эти группы отличаются тем, что белки b-типа содержат дублированную последовательность из примерно 120 остатков, что приводит к более высокой молекулярной массе (примерно 30 кДа по сравнению с 17 кДа).Белки b-типа связаны с поверхностью гранул крахмала и посттрансляционно расщепляются с образованием двух субъединиц (11 и 19 кДа), связанных одной дисульфидной связью (41). Ma et al. (43) показали, что сверхэкспрессия трансгена, кодирующего белок b-типа, приводит к улучшенным свойствам смешивания муки и увеличению доли крупных полимеров глютенина, предположительно из-за их способности образовывать межцепочечные дисульфидные связи.
Низкомолекулярные глиадины / пуринины имеют массу около 17-19 кДа (44) и более тесно связаны с γ-глиадинами в последовательности (41, 45).Возможно, их можно рассматривать как сходные с «предковыми» белками проламина до того, как они разошлись из-за развития и амплификации доменов повторяющейся последовательности. Примешивание гетерологично экспрессированных белков к тесту показало эффекты, аналогичные включению глиадинов (45).
Пуроиндолины (булавки) и протеин мягкости зерна (GSP)
Жесткость - одна из основных характеристик, используемых для разделения пшеницы на классы конечного использования. Он определяется локусом Hardness ( Ha ) на коротком плече хромосомы 5D мягкой пшеницы, хотя название вводит в заблуждение, потому что кодируемые гены фактически определяют мягкость.Этот локус отсутствует у твердой пшеницы, которая поэтому является сверхтвердой. Локус Ha включает три гена (46), кодирующих белки, называемые пуроиндолином a (Pin a), пуроиндолином b (Pin b) и белком мягкости зерна (GSP). Зрелые белки Pin a и Pin b содержат около 120 аминокислотных остатков, включая 10 остатков цистеина, которые образуют межцепочечные дисульфидные связи. Они также содержат пять (в Pin a) или три (в Pin b) остатка триптофана, которые сгруппированы вместе в последовательностях. Сравнение муки из непросеянной муки 40 сортов пшеницы (19 мягких и 21 твердых), выращенных на четырех французских участках, показало 0.029–0,060% сухой массы Pin a и 0,004–0,031% сухой массы Pin b (47). Различия в экспрессии этих белков и / или их аминокислотных последовательностей составляют около 75% вариации твердости зерна мягкой пшеницы (48).
Третий ген в локусе Ha кодирует белок, который расщепляется посттрансляционно, вероятно, в вакуоли, с помощью аспарагинилэндопротеиназы легумаинового типа, аналогичной ферменту (ам), ответственному за протеолиз белков глютена (как обсуждалось выше).Это высвобождает пептид из 15 остатков с N-конца (49). Этот пептид содержит три остатка пролина, которые гидроксилированы с образованием гидроксипролинов, а затем гликозилированы - цепями арабиногалактана с получением массы около 23 кДа (50). Полученный «арабиногалактановый пептид» (AGP) составляет около 0,39% от сухой массы белой муки (50) и легко ферментируется микрофлорой толстой кишки (51). Оставшаяся часть белка, называемая «белком мягкости зерна» (GSP), может вносить вклад в твердость в ограниченной степени [примерно на 10 единиц, измеренных Системой определения отдельных ядер Perten (SKCS)] (52), но биологические роли об AGP и GSP ничего не известно.
Неспецифические белки переноса липидов (БПЛ)
В отличие от других обсуждаемых здесь белков, LTP не ограничиваются тканями семян, злаками и другими видами трав. Хотя изначально они были определены на основании их способности переносить фосфолипиды между липосомами и мембранами in vitro , их истинная физиологическая роль неизвестна, а одна из возможных функций - способствовать защите от биотических стрессов. Они встречаются в двух классах, с массой около 9 кДа (LTP1) и 7 кДа (LTP2), и сосредоточены в слое алейронов и зародышах зерна пшеницы [обзор Marion et al.(53)]. Многие ЛТБ были идентифицированы как аллергены в семенах, фруктах и пыльце (53), при этом ЛТБ1 пшеницы способствует как пищевой аллергии, так и астме Пекарей (респираторная аллергия на пшеничную муку) (54, 55).
Ингибиторы α-амилазы / трипсина
Пшеничные ингибиторы α-амилазы и трипсина изучаются более 40 лет, что привело к появлению обширной и несколько запутанной литературы. Это частично является результатом сложности фракции, но также и использования различных номенклатур, основанных на относительной электрофоретической подвижности (основные компоненты обозначены как 0.19, 0,28 и 0,53), растворимость в хлороформе: метанол (называемый CM1-CM17) и субъединичная структура (встречаются мономерные, димерные и тетрамерные формы) (56). Dupont et al. (27) использовали масс-спектрометрию белков, разделенных с помощью 2D-электрофореза, чтобы идентифицировать два пятна, соответствующие формам предполагаемого мономерного ингибитора (ов) трипсина CM1 / 3, два из которых относятся к мономерному ингибитору амилазы WMAI, два относятся к гомодимерному ингибитору амилазы WDAI1, и девять относятся к субъединицам ингибитора гетеротетрамерной амилазы WTAI (1 × CM1, 2 × CM2, 2 × CM3, 2 × CM16 и 2 × CM17).Совсем недавно Geisslitz et al. (57) использовали целевую ЖХ-МС для количественной оценки количества основных ATI (WDAI / 0,19 + 0,53; WMAI1 / 0,28, CM2, CM3, CM16 и CM17), показав, что вместе они составляли 3,4–4,1 мг / г в цельнозерновой муке из мягкой пшеницы.
ATI пшеницы хорошо охарактеризованы как аллегены пшеницы, особенно при астме пекарей, а также при приеме пищи [обзор Salcedo et al. (58)]. Кроме того, они широко изучались в течение последних нескольких лет из-за предполагаемой роли в других побочных реакциях на потребление пшеницы, включая целиакию и нечувствительность к пшенице / глютену без целиакии (как обсуждается в других материалах этого специального раздела).
Сообщалось также, чтоATI способствуют повышению качества приготовления макаронных изделий, где первоначально сообщалось, что они являются компонентами глютенина (называемого твердым глютенином, богатым серой, DSG) (59–61).
Последствия целиакии
Зерно пшеницы содержит множество других белков, включая другие семейства ингибиторов протеаз и амилазы, тионины, белки, инактивирующие рибосомы, и предполагаемые белки, связанные с защитой, с неизвестными функциями [обзор Shewry et al. (34)].Все они могут присутствовать в пищевых продуктах, присутствовать либо в муке, либо в виде «загрязняющих примесей» в жизненно важном глютене. Однако описанные выше белки обладают некоторыми общими свойствами, которые могут иметь особое значение. Во-первых, большинство из них представляют собой небольшие глобулярные белки, которые плотно свернуты и стабилизированы множеством межцепочечных дисульфидных связей. Следовательно, они особенно устойчивы к нагреванию во время обработки пищи и к разложению в желудочно-кишечном тракте: хотя протеолиз может происходить, белки не распадаются, поскольку фрагменты удерживаются вместе дисульфидными связями.Во-вторых, они могут сильно взаимодействовать с белками глютена и, следовательно, присутствовать в жизненно важном глютене. Эти взаимодействия могут быть стабилизированы нековалентными силами, такими как низкомолекулярные глиадины / пуринины, или дисульфидными связями, образующимися либо во время развития и созревания зерна, либо перегруппировки во время обработки. Независимо от механизма, тот факт, что они могут присутствовать во фракциях «белка глютена», показывает, что их необходимо учитывать при интерпретации исследований, проведенных в отношении ответов человека на белки пшеницы.
Белки глютена обладают уникальными биофизическими свойствами, лежащими в основе обработки зерна
Несколько факторов способствовали глобальному успеху пшеницы, одним из которых является ее широкая адаптируемость. Однако основная причина, по которой во многих странах его предпочитают другим зерновым культурам, - это функциональные свойства пшеничной муки. Как обсуждалось выше, пшеница - единственная крупа, из которой можно выпекать квасный хлеб и другие хлебобулочные изделия, а также макароны и лапшу. Качество для этих конечных целей во многом определяется белками глютена, которые образуют непрерывную сеть в тесте.Эта сеть обеспечивает когезию, необходимую для изготовления таких продуктов, как макаронные изделия, а также вязкоупругость, необходимую для выпечки хлеба.
Несмотря на обширную литературу, молекулярная основа биофизических свойств глютена до сих пор полностью не изучена, и здесь невозможно дать подробное обсуждение. Однако два момента особенно важны. Во-первых, свойства зависят от вкладов как глиадинов, так и глютенинов, при этом субъединицы глютенина образуют большие трехмерные сети, стабилизированные межцепочечными дисульфидными связями, которые взаимодействуют с глиадинами, а с другими сетками глютенина за счет нековалентных сил, особенно водорода. облигации.Во-вторых, полимеры стабилизируются комбинацией сил. Важность дисульфидных связей легко продемонстрировать, поскольку они могут быть разрушены с помощью восстановителей с катастрофическим воздействием на функциональность. Важность водородных связей продемонстрировать труднее, но Белтон (35) предположил, что водородные связи особенно важны для разработки оптимальных белковых взаимодействий во время замеса теста.
Последствия целиакии
Наиболее очевидным следствием глютеновой болезни является то, что любое радикальное изменение состава фракции белка глютена и / или последовательностей отдельных субъединиц, вероятно, окажет влияние на функциональность.Хотя эти эффекты нелегко предсказать, тот факт, что пшеница для производства хлеба отбиралась по функциональным свойствам в течение почти столетия, предполагает, что большинство модификаций будут вредными. Таким образом, хотя может быть возможно производить «приемлемые» хлебцы из модифицированных линий пшеницы в лаборатории и в небольших системах [см., Например, (62, 63)], это гораздо более сложная задача для крупномасштабного коммерческого производства. где размер прибыли невысок и небольшие различия в параметрах, таких как высота буханки, текстура мякиша, цвет и срок хранения, будут влиять на качество продукта и, следовательно, на приемлемость для потребителей.
Заключение
Пшеничный глютен выполняет важную биологическую роль в качестве основной белковой фракции, запасающей зерно, и является основным фактором, определяющим функциональные (технологические) свойства зерна. Это очень сложная смесь белков, кодируемых мультигенными семействами в нескольких локусах трех геномов мягкой пшеницы, с высокой степенью полиморфизма между генотипами. Отдельные белки также имеют необычную структуру, включая обширные домены повторяющихся последовательностей.Кроме того, в зерне присутствует ряд родственных белков, которые могут присутствовать в изолированных фракциях глютена. Все эти факторы необходимо учитывать при изучении роли глютена при глютеновой болезни и других неблагоприятных реакциях на потребление пшеницы, а также при разработке стратегий по разработке безопасных типов пшеницы и продуктов из пшеницы.
Авторские взносы
PS написал всю статью. Часть рисунка 1 предоставлена коллегами.
Финансирование
Rothamsted Research получает грантовую поддержку от Совета по исследованиям биотехнологии и биологических наук (BBSRC) Великобритании, и эта работа является частью стратегической программы Designing Future Wheat (BB / P016855 / 1).
Заявление о конфликте интересов
Автор заявляет, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Я благодарен д-ру Д. Д. Касарде (USDA-ARS, WRRC, Олбани, Калифорния, США) за обсуждения и комментарии к тексту и д-ру С. Альтенбаху (USDA-ARS, WRRC, Олбани, Калифорния, США) за предоставленную копию ее принятой публикации.
Список литературы
1.Beccari JB. Де Фрументо . Bononia: De Bononiensi Scientifiarurm et Atrium atque Academia Commentarii Tomi Secundi (1745).
Google Scholar
2. Bailey CH. Перевод «О зерне» Беккари 1728. Cereal Chem. (1941) 18: 555–61.
Google Scholar
3. Дике В. К. (1950). Coeliakie . (Докторская диссертация). Утрехт: Утрехтский университет.
Google Scholar
4. Катасси С., Алаедин А., Боярски К., Боназ Б., Баума Г., Карроччо А. и др.Перекрывающаяся область чувствительности к глютену без целиакии (NCGS) и синдрома чувствительного к пшенице раздраженного кишечника (IBS): обновленная информация. Питательные вещества. (2017) 9: 1268. DOI: 10.3390 / nu9111268
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Юхас А., Белова Т., Флоридес К., Маулис К., Фишер И., Гелл Г. и др. Картирование генома семенных аллергенов и иммунореактивных белков пшеницы. Научно-исследовательский центр . (2018) 4: eaar8602. DOI: 10.1126 / sciadv.aar8602
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6.Ригли CW, Биц Дж. А. Белки и аминокислоты. В: Померанц Ю., редактор. Химия и технология пшеницы. 3-е изд. Святой Павел Mn: AACC (1988). с.159–275.
Google Scholar
7. Osborne TB. Растительные белки . 2-е изд. Лондон Великобритания: Лонгманс, Грин и Ко (1924).
Google Scholar
9. Шьюри П.Р., Татхам А.С., Барро Ф., Барсело П., Лаззери П. Биотехнология выпечки хлеба: раскрытие и управление комплексом мультибелкового глютена. Биотехнология. (1995) 13: 1185–90. DOI: 10.1038 / nbt1195-1185
CrossRef Полный текст | Google Scholar
10. Amend T, Beauvais F. Der Mechanis der Teigbildung: vorstoß in den molkularen Strukturbereich. Getreide Mehl Und Brot. (1995) 49: 359–62.
Google Scholar
11. Kent NL. Клетки субалеурона эндосперма с высоким содержанием белка. Cereal Chem. (1966) 43: 585–601.
Google Scholar
12.Хе Дж, Пенсон С., Пауэрс С., Хавс С., Шури П.Р., Този П. Пространственные закономерности распределения белка и полимера глютена в зерне пшеницы. J Agric Food Chem. (2013) 61: 6207–15. DOI: 10.1021 / jf401623d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Този П., Хе Дж., Лавгроув А., Гонсалес-Тюилье I, Пенсон С., Шури П.Р. Градиенты в композициях крахмалистого эндосперма пшеницы влияют на измельчение и переработку. TIFST. (2018) 82: 1–7.DOI: 10.1016 / j.tifs.2018.09.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Шури П.Р., Татхам А.С., Форд Дж., Крейс М., Мифлин Б.Дж. Классификация и номенклатура белков пшеничного глютена: переоценка. J Cereal Sci . (1986) 4: 97–106. DOI: 10.1016 / S0733-5210 (86) 80012-1
CrossRef Полный текст | Google Scholar
16. Бромилов С., Гетингс Л.А., Бакли М., Бромли М., Шури П.Р., Лэнгридж Д.И. и др. Кураторская база данных последовательностей белков глютена для поддержки разработки протеомных методов определения глютена в безглютеновых продуктах. Дж. Протеомика . (2017) 163: 67–75 DOI: 10.1016 / j.jprot.2017.03.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Bromilow SNL, Gethings LA, Langridge JI, Shewry PR, Buckley M, Bromley ML, et al. Комплексное протеомное профилирование глютена пшеницы с использованием комбинации независимого и зависимого от данных сбора данных. Фасадный завод Sci . (2017) 7: 2020. DOI: 10.3389 / fpls.2016.02020
.Что содержит глютен? 12 источников пищи
Жизнь полна сюрпризов. Если вы страдаете симптомами непереносимости глютена, вам следует постоянно думать о том, что в нем содержится.
Белок, содержащийся в пшенице, ячмене и ржи, глютен бывает разных видов. Это может быть наполнитель, связующее, загуститель и даже усилитель белка. Так что же в нем глютен? Некоторые ответы могут застать вас врасплох. Знаете ли вы, например, что глютен может содержать суп, суши, мороженое и даже кетчуп?
Мы спросили нескольких ведущих диетологов, которые являются экспертами по безглютеновой диете, о том, что в ней содержится, включая некоторые из самых удивительных мест, где вы можете найти глютен.Эта информация особенно важна, если вы хотите приготовить блюда без глютена. В конце концов, задача 1 состоит в том, чтобы определить, подаете ли вы случайно продукты с глютеном по рецепту, который, как утверждается, не содержит глютен.
Вот наш список из дюжины продуктов, которые могут содержать глютен.
1. Соевый соус
Можно подумать, что соевый соус можно просто приготовить из соевых бобов, но это не так, - говорит Рэйчел Бегун, доктор медицины, специалист по глютеновым заболеваниям из Боулдера, штат Колорадо. ; некоторые бренды содержат почти равные количества сои и пшеницы.И посмотрите за бутылку. Соевый соус также содержится во многих заправках для салатов, соусах, маринадах (например, терияки), а также в упакованных и замороженных продуктах. Многие соевые соусы в стиле тамари - но не все - не содержат глютен.
Ищите: Тамари без глютена (обратите внимание на бренды Eden organic и San-J) и соевый соус Kikkoman без глютена. Bragg Liquid Aminos - еще один безглютеновый выбор, как и сырые кокосовые аминокислоты Coconut Secret.
2. Овес
Не содержит ли овсянку глютена? Хотя овес не содержит глютен от природы, большинство обычных овсов заражены пшеницей (или ячменем, или рожью) во время выращивания, сбора урожая, обработки и упаковки.Ищите сертифицированный овес без глютена, - говорит Марлиса Браун, магистр медицины, доктор медицинских наук, автор книги Без глютена, без проблем. Овес без глютена содержит менее 20 частей на миллион (ppm) глютена. В отличие от этого, некоторые обычные овсяные хлопья были протестированы на содержание до 1800 частей на миллион глютена.
Ищите: Сертифицированный безглютеновый овес от GF Harvest, Montana’s Gifts of Nature, Cream Hill Estates и Bob’s Red Mill. Овсяные хлопья быстрого приготовления без глютена можно приобрести в магазинах Glutenfreeda и Bakery On Main.
3. Куриный бульон
Многие люди не понимают, что пшеница может быть добавлена в куриный бульон, - говорит Сюзанна Симпсон, доктор медицинских наук, клинический диетолог в Центре глютеновой болезни при Медицинском центре Колумбийского университета. Бульонные кубики и суповые смеси также могут содержать глютен в качестве связующего.
Ищите: Куриный бульон и супы без глютена от Imagine, Pacific Foods and Kitchen Basics.
4. Кукурузные хлопья и рисовые криспи
Эти хлопья на основе кукурузы и риса могут показаться безопасными, но обычно они содержат солодовый ароматизатор, сделанный из ячменя, говорит Симпсон.Не содержит ли ячменный глютен? Нет, в ячмене есть глютен. Но ячмень не входит в восьмерку основных аллергенов, и его не нужно указывать на пищевых этикетках, поэтому ищите злаки с маркировкой «без глютена».
Ищите: Kellogg’s Rice Krispies без глютена, кукурузные хлопья Erewhon и хлопья с коричневым рисом Erewhon Crispy, а также хлопья Chex без глютена.
5. Солодка
Красный или черный, лакричник запрещен. В то время как корень солодки не содержит глютена, палочки солодки и леденцы почти всегда готовятся из пшеничной муки - и ее довольно много.
Ищите: Солодка Оргран Меласса и Скоттис Солодки Кардана.
6. Имитация краба
Когда вы заказываете блюдо с крабовым мясом, такое как суши, калифорнийские роллы или крабовый соус, спросите, сделано ли оно из имитационного краба, говорит Симпсон. Имитация краба изготавливается из белой рыбы, такой как минтай, пшеница, красители и ароматизаторы, которые вместе напоминают снежного краба.
Ищите: Суши из настоящего крабового мяса или краба в мягком панцире.
7. Мясные деликатесы
Хотя многие мясные деликатесы не содержат глютен, следите за слайсером, говорит Симпсон, поскольку мясо, содержащее глютен, можно нарезать на том же оборудовании. Купите предварительно упакованные мясные деликатесы с четкой маркировкой «без глютена» или попросите человека у стойки гастронома сменить перчатки и выбросить первые один или два куска мяса из вашего заказа.
Ищите: Мясо без глютена от Applegate, Boar’s Head, Columbus и Dietz & Watson.

Любители шоколада на безглютеновой диете должны избегать продуктов, содержащих пшеничный, ячменный солод или просто солод.Внимательно проверяйте этикетки.
8. Шоколад
Не унывайте, любители шоколада. По словам Симпсона, многие марки плиток и чипсов из молочного и темного шоколада действительно безопасны, но для уверенности просмотрите список ингредиентов на предмет пшеницы, ячменного солода или просто солода. Также остерегайтесь любого шоколада с хрустящей корочкой или хрустящей корочкой.
Ищите: Маркированный шоколад без глютена от Enjoy Life, Endangered Species, Chocolate и Scharffen Berger.
9. Соленья и другие маринованные продукты
Солодовый уксус, содержащий глютен, иногда используется в процессе маринования, говорит Рэйчел Бегун.Хотя дистиллированный уксус не содержит глютена (процесс дистилляции удаляет белок глютена), солодовый уксус ферментируется, а не дистиллируется, поэтому он не является безглютеновым.
Ищите: Mt. Оливки, Бубби и соленые огурцы Хайнц.
10. Томатная паста
Эта кладовая обычно представляет собой безопасный продукт из одного ингредиента. Но когда дело доходит до глютена, вы всегда должны читать этикетки, потому что из этого правила есть исключения, - говорит Бегун. Ароматизированная томатная паста (например, томатная паста с итальянскими травами) может содержать глютен.
Ищите: Простая томатная паста, включая продукты от Bionaturae, Cento и Muir Glen.
11. «Товары без пшеницы»
Продукты с маркировкой «не содержат пшеницу» не всегда содержат глютен. Показательный пример: оболочки для пирогов «без пшеницы» можно приготовить из ржаной муки или полбы, а печенье «без пшеницы» может содержать овсяную муку или ячменный солод. Согласно новому правилу маркировки FDA, зерна, содержащие глютен (например, пшеничный крахмал), которые были обработаны для удаления глютена, могут быть разрешены в пищевых продуктах без глютена, если общее содержание глютена составляет менее 20 частей на миллион.По словам Марлисы Браун, это, вероятно, нормально для больных целиакией, но может стать проблемой для людей с аллергией на пшеницу.