Пептиды содержание в продуктах питания
список, полезные советы и рекомендации – Женские Вопросы
...
Сегодня модно серьезно относиться к своему здоровью – отказываться от вредных привычек, правильно питаться и заниматься спортом. Человек, следящий за тем, что он ест, может прожить дольше и позже состариться. Далеко не последнюю роль в продлении молодости организма играют пептиды.
Что такое пептиды и зачем они нужны?
Пептиды – это вещества, молекулы которых состоят из двух или более аминокислот. Пептиды регулируют огромное количество процессов в человеческом организме, в том числе и регенерацию клеток. С регенерацией клеток могут возникнуть значительные проблемы, если питание будет неправильным и человек не будет получать достаточного количества пептидов.
Если пытаться понять, что такое пептиды на еще более простом языке, то можно выяснить, что они являются частью белка, а белок в свою очередь – строительный материал для организма. Без белка невозможно иметь здоровое тело, мышцы, волосы и ногти. Организм должен в достаточном количестве получать их из различных продуктов питания.
Важно учитывать, что с годами, а также под воздействием постоянных тяжелых физических нагрузок, стрессов и болезней, организм начинает обрабатывать все меньше и меньше пептидов, что, конечно же, отражается на физиологических процессах. Именно по этой причине замедляется регенерация клеток и человек стареет.
Список продуктов питания, в которых содержатся пептиды
Не стоит расстраиваться, ведь при должном старании можно долгое время поддерживать в организме нужный уровень пептидов. Особое внимание необходимо уделить питанию и определенным продуктам. Как уже говорилось выше, пептиды состоят из аминокислот, а аминокислоты в свою очередь получаются из белка. Следовательно, человеку необходимо в достаточном количестве употреблять те продукты, которые содержат много белка:
Мясо

Предпочтение следует отдавать курице, индейке и кролику, так как эти сорта мяса лучше всего усваиваются организмом. Однако не стоит есть мясо три раза в день, следует ограничиться всего одним таким приемом пищи.
От свинины лучше всего отказаться полностью, а говядину употреблять в умеренных количествах. При этом мясо не стоит покупать в супермаркетах, так как от него вы получите больше вреда, чем пользы.
Яйца

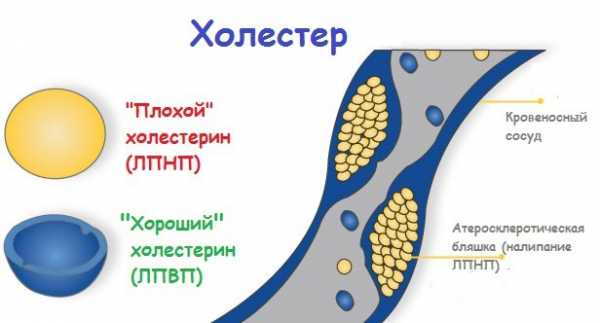
Они могут быть как куриные, так и перепелиные. Не стоит бояться этого продукта и холестерина, который там якобы содержится. Есть яйца можно ежедневно, в количестве 1-3 в зависимости от того, насколько активным является ваш образ жизни. Лучше всего употреблять яйца в варенном виде.
Молочные продукты

Взрослому человеку не стоит пить в больших количествах цельное молоко, а вот такие продукты, как творог и кефир, можно употреблять каждый день. Главное – не выбирать обезжиренные продукты, так как в них меньше пользы. Жирность должна быть средней: для творога – 5%, для кефира – 2,5%.
Рыба и морепродукты

Идеально, если вы сможете есть рыбу каждый день. Если же этого сделать нельзя, то данный продукт следует включить в свой рацион хотя бы пару раз в неделю. Можно есть как красную рыбу, так и белую. Главное, чтобы она была качественной и свежей.
Можно подумать, что белок содержится только в продуктах животного происхождения и вегетарианцы обречены. На самом деле это не так и белок (а значит и пептиды) можно получать из растительной пищи.
Крупы

Гречка, рис, киноа, булгур и кус кус также входят в список продуктов питания, содержащих пептиды. По утрам можно есть пшенную, овсяную, кукурузную или ячневую кашу. В этих продуктах содержится от 7 до 15 грамм белка на 100 грамм сухой крупы.
Бобовые

Нут, горох, фасоль, чечевица и маш. По содержанию белка бобовые не уступают мясу.
Производные из сои

Тофа и соевое мясо. Соя вообще считается лидером по содержанию в ней пептидов.
При достаточном количестве белковой пищи в организме не возникнет дефицита пептидов.
Каковы они, применение и побочные эффекты
Пептиды - это уменьшенные версии белков. Многие продукты для здоровья и косметические продукты содержат различные пептиды для различных целей, например, для их потенциальных антивозрастных, противовоспалительных свойств или свойств для наращивания мышечной массы.
Недавние исследования показывают, что некоторые типы пептидов могут играть полезную роль в замедлении процесса старения, уменьшении воспаления и уничтожении микробов.
Люди могут спутать пептиды с белками. И белки, и пептиды состоят из аминокислот, но пептиды содержат гораздо меньше аминокислот, чем белки.Как и белки, пептиды естественным образом присутствуют в продуктах питания.
Из-за потенциальной пользы пептидов для здоровья доступно множество добавок, содержащих пептиды, полученные производителями либо из продуктов питания, либо синтетическим путем.
Некоторые из самых популярных пептидов включают пептиды коллагена для борьбы со старением и здоровья кожи, а также креатиновые пептидные добавки для наращивания мышечной массы и улучшения спортивных результатов.
В этой статье мы обсуждаем потенциальные преимущества и побочные эффекты пептидных добавок.
Пептиды - это короткие цепочки аминокислот, обычно состоящие из 2–50 аминокислот. Аминокислоты также являются строительными блоками белков, но в белках их больше.
Пептиды легче усваиваются организмом, чем белки, поскольку они меньше по размеру и более расщепляются, чем белки. Они могут легче проникать через кожу и кишечник, что помогает им быстрее попадать в кровоток.
Пептиды в добавках могут происходить из растительных или животных источников белка, в том числе:
- яйца
- молоко
- мясо
- рыба и моллюски
- бобы и чечевица
- соя
- овес
- льняное семя
- конопля семена
- пшеница
Ученых больше всего интересуют биоактивные пептиды, или пептиды, которые благотворно влияют на организм и могут положительно влиять на здоровье человека.
Различные биоактивные пептиды обладают разными свойствами. Воздействие, которое они оказывают на организм, зависит от последовательности содержащихся в них аминокислот.
Некоторые из наиболее распространенных доступных пептидных добавок:
- Коллагеновые пептиды, которые могут принести пользу здоровью кожи и обратить вспять эффекты старения.
- Креатиновые пептиды, которые могут увеличить силу и мышечную массу.
Некоторые люди могут принимать другие пептиды и пептидные гормоны для повышения спортивной активности.Однако Всемирное антидопинговое агентство запретило многие из них, включая фоллистатин, пептид, который увеличивает рост мышц. Возможные преимущества пептидов включают уменьшение воспаления, улучшение иммунной функции и предотвращение образования тромбов.
Исследования показывают, что биоактивные пептиды могут:
Люди часто используют пептиды для достижения следующих эффектов:
Замедление процесса старения
Коллаген - это белок кожи, волос и ногтей.Пептиды коллагена - это расщепленные белки коллагена, которые организм может легче усваивать. Прием пептидов коллагена может улучшить здоровье кожи и замедлить процесс старения.
Некоторые исследования показывают, что диетические пищевые добавки, содержащие пептиды коллагена, могут лечить морщины на коже. Другие исследования показывают, что эти добавки могут также улучшить эластичность и увлажнение кожи.
Пептиды могут стимулировать выработку меланина, пигмента кожи, который может улучшить защиту кожи от солнечных лучей.
Актуальная антивозрастная косметика может также содержать пептиды, которые, по утверждению производителей, могут уменьшить морщины, помочь укрепить кожу и увеличить кровоток.
Улучшить заживление ран
Поскольку коллаген является жизненно важным компонентом здоровой кожи, пептиды коллагена могут способствовать более быстрому заживлению ран.
Биоактивные пептиды также могут уменьшать воспаление и действовать как антиоксиданты, что может улучшить способность организма к заживлению.
В настоящее время продолжаются исследования противомикробных пептидов, которые также могут улучшить заживление ран.Очень высокий или очень низкий уровень некоторых антимикробных пептидов может способствовать развитию кожных заболеваний, таких как псориаз, розацеа и экзема.
Предотвращение возрастной потери костной массы
Исследования на животных связывают умеренное потребление пептидов коллагена с увеличением костной массы у растущих крыс, которые также выполняли беговые упражнения.
Исследование может указать на то, что пептиды коллагена являются полезным способом противодействовать возрастной потере костной массы. Однако необходимы дополнительные исследования, особенно на людях.
Увеличение силы и мышечной массы
Некоторые исследования пожилых людей показывают, что добавки пептида коллагена могут увеличивать мышечную массу и силу. В исследовании участники совмещали прием добавок с тренировками с отягощениями.
Креатиновые пептиды также могут улучшить силу и помочь нарастить мышцы.
В то время как энтузиасты фитнеса уже много лет используют порошки креатинового протеина, популярность креатиновых пептидов растет.
Эти конкретные пептиды легче усваиваются организмом, а это означает, что они могут вызывать меньше проблем с пищеварением, чем протеины креатина.
Для здоровых людей пептидные добавки вряд ли вызовут серьезные побочные эффекты, потому что они похожи на пептиды, присутствующие в повседневной пище.
Пероральные пептидные добавки могут не попадать в кровоток, так как организм может расщеплять их на отдельные аминокислоты.
В одном исследовании, в котором женщины принимали пероральные добавки пептида коллагена в течение 8 недель, исследователи не отметили каких-либо побочных реакций.
Однако Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) не регулирует пищевые добавки так же, как лекарства.В результате люди должны проявлять осторожность при приеме любых добавок.
Кремы и мази для местного применения, содержащие пептиды, могут вызывать кожные симптомы, такие как чувствительность кожи, сыпь и зуд.
Люди всегда должны покупать у уважаемой компании и прекращать использование при возникновении побочных реакций.
Также рекомендуется поговорить с врачом перед приемом пептидных добавок или использованием продуктов местного действия, содержащих пептиды.
Беременным, кормящим грудью, принимающим лекарства или больным заболеванием следует избегать использования пептидов, пока они не поговорили со своим врачом.
Время приема пептидных добавок и их доза будут варьироваться в зависимости от типа и марки.
Всегда следуйте инструкциям на упаковке при приеме пептидных добавок или использовании пептидных кремов или лосьонов для местного применения. Никогда не превышайте рекомендуемый размер порции. Прекратите использование и обратитесь к врачу, если возникнут побочные реакции.
Пептиды естественным образом присутствуют в продуктах, богатых белком. Нет необходимости принимать пептидные добавки или использовать местные источники пептидов.
Однако некоторые люди могут захотеть использовать пептиды коллагена с целью замедления процесса старения.Другие могут принимать пептиды креатина для наращивания мышц и силы.
Доказательства эффективности этих продуктов ограничены, и для тщательной оценки их эффективности и безопасности необходимы дополнительные исследования.
Исследования пептидов находятся на начальной стадии, и в будущем ученые могут обнаружить преимущества для здоровья различных типов пептидов. До тех пор люди должны проявлять осторожность при приеме любых добавок и заранее обсудить потенциальные преимущества и риски со своим врачом.
.границ | Пептиды и прием пищи
Введение
Питательные вещества, созданные в результате переваривания пищи, предназначены для активации рецепторов, связанных с G-белком, на просветной стороне энтероэндокринных клеток, например, L-клеток. Это стимулирует выброс гормонов кишечника. Гормоны, выделяемые из кишечника и жировой ткани (ЖТ), играют важную роль в регулировании приема пищи и расхода энергии (1).
Многие циркулирующие сигналы, включая гормоны кишечника, могут напрямую влиять на активность нейронов дугообразного ядра (ARC) после прохождения через срединное возвышение.ARC примыкает к срединному возвышению, перижелудочковому органу с фенестрированными капиллярами и, следовательно, неполным гематоэнцефалическим барьером (ГЭБ) (2). ARC играет решающую роль в регуляции приема пищи и энергетического гомеостаза. ARC содержит две популяции нейронов с противоположным влиянием на потребление пищи (3). Медиально расположенные орексигенные нейроны экспрессируют нейропептид Y (NPY) и родственный агути белок (AgRP) (4, 5). Анорексигенные нейроны (то есть те, которые подавляют аппетит) в латеральном ARC экспрессируют альфа-меланоцит-стимулирующий гормон (α-MSH), полученный из проопиомеланокортина (POMC) и транскрипта, регулируемого кокаином и амфетамином (CART) (6).Баланс между активностями этих нейронных цепей имеет решающее значение для регуляции массы тела.
Напротив, другие периферические сигналы влияют на гипоталамус косвенно через афферентные нейрональные пути и цепи ствола мозга. В этом контексте желудочно-кишечные афференты влагалища активируются механорецепторами и хеморецепторами и сходятся в ядре солитарных трактов (NTS) ствола мозга. Нейрональные проекции от NTS, в свою очередь, передают сигналы в гипоталамус (1, 7).Гормоны кишечника также изменяют активность восходящего пути блуждающего нерва от кишечника к стволу мозга. В случае грелина и пептидного тирозинтирозина (PYY) есть некоторые доказательства прямого действия как на ARC, так и на блуждающий нерв и ствол мозга.
Аксоны этих нейронов проецируются на нейроны «второго порядка», частично расположенные в паравентрикулярном ядре (PVN), где секретируются анорексигенные вещества тиреотропин-рилизинг-гормон (TRH), кортикотропин-рилизинг-гормон (CRH) и окситоцин. и, частично, в латеральной гипоталамической (LH) и перифорникальной областях (PFA), где продуцируются молекулы орексанта, меланин-концентрирующий гормон (MCH) и орексины.Когда жировые сигналы достигают ARC, высвобождаются анорексигенные пептиды, которые активируют катаболический цикл. Напротив, активация анаболического пути приводит к высвобождению орексигенных пептидов и происходит, когда концентрации сигнала ожирения в мозгу низкие, что указывает на срочность пополнения запасов топлива (8).
Гормоны периферического кишечника
Орексигенные пептиды
Грелин
Грелин представляет собой пептид, состоящий из 28 аминокислот, и необычен среди пептидных гормонов тем, что Ser3 n -октаноилирован.
Грелин присутствует в X / A-подобных клетках, на долю которых приходится примерно 20% популяции эндокринных клеток кислородных желез взрослых (9). Грелин-иммунореактивные клетки также обнаруживаются в двенадцатиперстной кишке, тощей кишке, подвздошной и толстой кишке. В кишечнике концентрация грелина постепенно снижается от двенадцатиперстной кишки к толстой кишке. Этот пептид также секретируется другими органами, такими как гипоталамус и поджелудочная железа крыс, и, кроме того, мРНК грелина экспрессируется в различных органах (10, 11).Самый известный фактор, регулирующий секрецию грелина, - это кормление. Концентрация грелина в плазме крови увеличивается при голодании и снижается после приема пищи. Факторы, участвующие в регуляции секреции грелина, еще не идентифицированы. Уровни глюкозы в крови могут быть наиболее вероятным кандидатом; таким образом, пероральное или внутривенное введение глюкозы, снижающей концентрацию грелина в плазме, демонстрирует ночное повышение и является низким у тучных людей и высоким у худых (12–18). Экзогенный гормон роста (GH) снижает экспрессию мРНК грелина в желудке и концентрацию грелина в плазме, но не влияет на запасы грелина в желудке (19).
Локализация рецепторов грелина на афферентных нейронах блуждающего нерва в узловатом ганглии крысы предполагает, что сигналы грелина из желудка передаются в мозг через блуждающий нерв (20, 21). Таким образом, грелин секретируется в первую очередь из желудка в ответ на голод и голод, циркулирует в крови и служит периферическим сигналом, информируя центральную нервную систему (через блуждающий нерв) о стимулировании кормления. Грелин-содержащие нейроны также обнаруживаются в ARC гипоталамуса, области, участвующей в регуляции аппетита (1).Фактически, интрацеребровентрикулярная (ICV) инъекция грелина увеличивает совокупное потребление пищи и снижает расход энергии, что приводит к увеличению массы тела (21–24). Чтобы стимулировать высвобождение орексигенных пептидов, грелин-содержащие нейроны посылают эфферентные волокна на нейроны, экспрессирующие NPY и AgRP. С другой стороны, чтобы подавить высвобождение анорексигенного пептида, грелин-содержащие нейроны посылают эфферентные волокна на нейроны POMC. ARC также является мишенью для лептина, гормона, подавляющего аппетит, вырабатываемого AT (25).Лептин напрямую подавляет стимулирующие аппетит эффекты NPY и AgRP, тогда как гипоталамический грелин блокирует вызванное лептином сокращение кормления. Таким образом, грелин и лептин конкурируют друг с другом при регулировании кормления.
Грелин - это всего лишь сигнал голода от периферических тканей. Внутривенные и подкожные инъекции грелина увеличивают потребление пищи; Аналогичным образом, грелин, вводимый периферически, стимулирует нейроны гипоталамуса и прием пищи (22, 23, 26–28). Поскольку скорость, с которой периферический грелин проходит через ГЭБ, очень мала, периферический грелин должен активировать соответствующие области гипоталамуса непрямым путем (29).
Кроме того, сообщалось, что фермент грелин O -ацилтрансфераза, необходимый для ацилирования грелина, регулируется доступностью питательных веществ, зависит от конкретных пищевых липидов в качестве субстратов ацилирования. Таким образом, этот механизм может действовать как датчик питательных веществ, используя абсорбируемые жирные кислоты, чтобы сигнализировать мозгу о доступности высококалорийной пищи, что приводит к оптимизации распределения питательных веществ (30).
Анорексигенные средства
Пептид тирозин тирозин
Пептидный тирозин-тирозин состоит из 36 аминокислот, содержит несколько остатков тирозина и требует амидирования на С-конце для биологической активности.
Низкие уровни PYY обнаруживаются в энтероэндокринных клетках желудка, а уровни повышаются в дистальном направлении вдоль тонкой и толстой кишки, достигая наивысшего уровня в клетках толстой и прямой кишки (31). PYY высвобождается из энтероэндокринных L-клеток, выстилающих дистальный отдел желудочно-кишечного тракта, пропорционально потребляемой калорийности. Уровни PYY в плазме повышаются в течение 30 минут после еды, а у людей уровни циркулирующей крови выходят на плато через 1-2 часа после приема пищи, оставаясь повышенными до 6 часов (32).Богатые белком продукты вызывают наибольшее повышение уровня PYY по сравнению с другими макроэлементами (33, 34). Аноректические эффекты PYY 3–36 , по-видимому, опосредуются централизованно через ARC. PYY 1–36 и PYY 3–36 оказывают свое влияние через семейство NPY (35). PYY 1–36 связывается с аналогичным сродством с рецепторами NPY. Однако PYY 3–36 является селективным высоким сродством к подтипу рецептора Y 2 (Y 2 R) (36), который, как полагают, является рецептором, ответственным за снижение потребления пищи PYY.Путь, опосредованный стволом мозга блуждающего нерва, также может участвовать в действиях циркулирующего PYY 3–36 . PYY присутствует в нейронах кишечного нервного сплетения, иннервирующих желудочно-кишечный тракт, и рецептор Y 2 R был идентифицирован на блуждающем нерве (37), эффекты PYY 3–36 на чувство насыщения и центральный контроль аппетита очевидны. Большинство из них опосредуются через популяции аноректических нейронов в ARC, но блуждающие пути / ствол мозга и периферические эффекты PYY на опорожнение желудка и перистальтику кишечника также могут иметь значение.
Полипептид поджелудочной железы
Полипептид поджелудочной железы (PP) представляет собой амидированный пептид из 36 аминокислот, который принадлежит к семейству пептидов «PP-fold». Он высвобождается постпрандиально под блуждающим контролем PP-клетками панкреатических островков (38). PP сопоставим с другими аноректическими кишечными пептидами, такими как PYY, секретируясь пропорционально потребляемой калорийности.
Полипептиды поджелудочной железы связываются со всеми членами семейства рецепторов Y, но имеют самое высокое сродство к подтипу рецепторов Y 4 (39).Эффекты PP, вероятно, будут опосредованы вентромедиальным гипоталамусом (VMH), паравентрикулярным гипоталамусом (PVN) и стволом мозга [area postrema (AP) и ARC] (40) в областях, центральных для контроля аппетита. Анорексические эффекты PP у людей, по-видимому, не зависят от изменений моторики желудка (41).
Холецистокинин
Холецистокинин (CCK) высвобождается после приема пищи из тонкого кишечника (42), а также было показано, что он локализуется совместно с PYY в L-клетках (43).Он высвобождается в ответ на насыщенные жиры, длинноцепочечные жирные кислоты, аминокислоты и небольшие пептиды, которые обычно возникают в результате переваривания белка (44, 45). Рецепторы CCK1 присутствуют в периферических тканях, таких как поджелудочная железа, желчный пузырь и на афферентных нервных волокнах блуждающего нерва, иннервирующих кишечник (46). Кроме того, рецепторы CCK1 были идентифицированы в областях ЦНС, участвующих в регуляции приема пищи, таких как NTS, AP и дорсомедиальный гипоталамус (47). Рецептор CCK2 имеет другое распределение.Он обнаруживается в коре головного мозга, гипоталамусе, афферентах блуждающего нерва и слизистой оболочке желудка, снова охватывая несколько областей, которые, как известно, участвуют в регуляции аппетита. У людей внутривенное введение физиологических доз ХЦК снижает потребление пищи и усиливает ощущение насыщения (48).
Лептин
Лептин - это белок из 167 аминокислот, который, как известно, подавляет аппетит и регулирует расход энергии. Лептин секретируется в основном адипоцитами (49), но также обнаружен в желудке (50) и гипофизе (51).Тем не менее, АТ остается его основным источником, ответственным за 95% продукции лептина (51). Уровни циркулирующего лептина положительно коррелируют с индексом массы тела (ИМТ) и массой АТ. Адипоциты обладают большим количеством рецепторов GH (GHR), и известно, что GH напрямую регулирует экспрессию гена лептина (52). Кроме того, на выработку лептина влияют несколько регуляторов, которые стимулируются инсулином и глюкозой в крови, но ингибируются симпатической активностью, липолитическими катехоламинами и свободными жирными кислотами (FFA).Продукция лептина положительно коррелирует с массой АТ (53) и не зависит от ожирения. По этой причине уровень лептина у женщин выше, чем у мужчин (54). У людей существует высокоорганизованный паттерн секреции лептина в течение 24 часов. В целом, циркадный ритм характеризуется базовыми уровнями между 08:00 и 12:00 часами, прогрессивно повышающимися до пика между 24:00 и 04:00 часами и неуклонно снижающимися до надира к 12:00 (55). Ночное повышение секреции лептина связано с приемом пищи, вероятно, из-за кумулятивной гиперинсулинемии за весь день (54).Лептин секретируется в регулярном пульсирующем режиме с межпиковым интервалом около 44 минут, а циркадный ритм объясняется исключительно увеличением высоты пульса. Циркулирующий лептин транспортируется через ГЭБ посредством процесса насыщения. Голодание снижает транспорт, тогда как повторное кормление увеличивает транспорт лептина через ГЭБ (56, 57).
Лептин транспортируется через ГЭБ с помощью насыщающейся транспортной системы (58) и проявляет свой аноректический эффект через ARC, где нейроны NPY / AgRP и POMC / CART экспрессируют рецепторы лептина (59).Лептин ингибирует нейроны NPY / AgRP и активирует нейроны POMC / CART (60, 61), что приводит к снижению потребления пищи. Он также влияет на секрецию нейропептидов, участвующих в энергетическом гомеостазе, таких как CRH, TRH и BDNF (62–65). Кроме того, лептин стимулирует адренергическую систему, увеличивая расход энергии (66). В дополнение к его взаимодействию с центральными нервными процессами, есть доказательства синергизма между лептином и эпизодическим фактором сытости CCK, о котором говорилось ранее (67). Было показано, что лептин усиливает насыщающий эффект ХЦК (68).Кроме того, индуцированное лептином подавление соматостатинергической системы гиппокампа может усиливать его анорексигенный эффект (69).
Амилин
Амилин представляет собой пептид из 37 аминокислот, также известный как островковый амилоидный полипептид. У млекопитающих амилин совместно с инсулином высвобождается из β-клеток поджелудочной железы в ответ на прием пищи и имеет аноректический эффект (70). Амилин, по-видимому, снижает потребление пищи за счет как центральных, так и периферических механизмов и, косвенно, замедляя опорожнение желудка.AP играет преобладающую роль в эффекте насыщения периферического амилина, включая прямую активацию AP-нейронов амилином, передаваемым через кровь. Его аноректический эффект частично может быть связан со снижением экспрессии орексигенных нейропептидов в области ЛГ (71). Имеются данные о том, что амилин также может оказывать свое действие через серотонинергические, гистаминергические и дофаминергические системы.
Инсулин
Инсулин вырабатывается β-клетками островков Лангерганса поджелудочной железы и попадает в мозг из кровотока, воздействуя на нейрон гипоталамуса, расположенный в основном в ARC, для снижения потребления энергии.Существует также специфический транспорт инсулина через ГЭБ, регулируемый механизмом насыщения, который включает рецепторы инсулина в микрососудах мозга. Инфузия ICV или системная инъекция инсулина приводит к дозозависимому подавлению приема пищи. Центральное действие инсулина способствует анорексии, поскольку снижает NPY и стимулирует экспрессию POMC (72). Инсулин связывается со своими рецепторами, высоко экспрессируемыми в нейронах POMC / CART и NPY / AgRP. И инсулин, и лептин активируют нейроны POMC, но, по-видимому, они по-разному регулируют AgRP, при этом лептин ингибирует, а инсулин стимулирует его синтез (73).Дефицит инсулина связан с увеличением NPY, тогда как введение инсулина подавляет экспрессию NPY в гипоталамусе.
Глюкагоноподобные пептиды
Экспрессия гена пре-проглюкагона ограничена α-клетками поджелудочной железы, L-клетками кишечника и нейронами в ядре ствола мозга NTS. В то время как посттрансляционный процессинг проглюкагона в поджелудочной железе приводит к образованию глюкагона и основного фрагмента проглюкагона, протеолитическое расщепление в L-клетках кишечника и в NTS дает пептиды глицентин, оксинтомодулин (OXM), глюкагоноподобные пептиды. 1 и 2 (ГПП-1 и -2) (74).После еды GLP-1 и GLP-2 параллельно секретируются в кровоток. GLP-1, пожалуй, наиболее известен как инкретиновый гормон кишечного происхождения. GLP-1 представляет собой пептид из 30 аминокислот и один из нескольких продуктов расщепления гена пре-проглюкагона. Он секретируется энтероэндокринными L-клетками дистального отдела кишечника в ответ на поступающие питательные вещества (75). GLP-1 также является нейротрансмиттером, синтезируемым небольшой популяцией нейронов в NTS в хвостовом стволе мозга (76). Прием пищи способствует высвобождению GLP-1 из L-клеток в кишечнике, что активирует афференты блуждающего нерва.(77). GLP-2 представляет собой пептид, высоко консервативный у различных видов млекопитающих. Его основные биологические эффекты связаны с регулированием поглощения энергии и поддержанием морфологии слизистых оболочек, а также функции и целостности кишечника. В желудочно-кишечном тракте GLP-2 увеличивает поглощение питательных веществ в просвете, включая сахара и липиды, за счет увеличения активности и экспрессии переносчика питательных веществ. Его влияние на регуляцию аппетита неясно, но недавние исследования показали, что внутрибрюшинное введение GLP-2 снижает потребление пищи мышами (78).
Оксинтомодулин
Оксинтомодулин представляет собой пептид из 37 аминокислот, высвобождаемый после приема пищи из L-клеток пропорционально потреблению калорий. OXM (79) вызывает снижение нейрональной активности в ARC, PVN и супраоптическом ядре. Этот паттерн активации отличается от такового у GLP-1 в тех же условиях (80), что означает, что эти два гормона действуют через разные гипоталамические пути. ОХМ снижает потребление пищи добровольцами с нормальным весом при внутривенном или подкожном введении (81).Есть доказательства того, что ОХМ может увеличивать расход энергии у человека (82).
Bombesin
Бомбезин - тетрадекапептид, выделенный из кожи земноводных и сходный по структуре с гастрин-высвобождающим пептидом (GRP) млекопитающих и нейромедином B (83, 84). Введение бомбезина (85, 86) и GRP (87) снижает потребление пищи у худых людей, но не у женщин с ожирением (88). Периферическое или центральное введение бомбезина снижает потребление пищи, которая не блокируется ваготомией (89, 90).Бомбезин также активирует симпатическую нервную систему (91). У животных, которые голодали или имели вентромедиальные поражения гипоталамуса, бомбезин вызывает сильное снижение температуры, поскольку симпатическая нервная система не может быть активирована (91, 92).
Обестатин
Недавно было продемонстрировано, что препрогрелин подвергается дополнительному протеолитическому расщеплению с образованием пептида из 23 аминокислот, который был назван обестатином. В отличие от грелина, обестатин обладает анорексигенным действием, уменьшает опорожнение желудка, подавляет сокращения тощей кишки и подавляет набор массы тела (93).Однако несколько недавних исследований, проведенных на крысах и мышах в различных экспериментальных условиях, не воспроизвели эти результаты (94, 95). Pan et al. (96) сообщили, что обестатин не может пересекать ГЭБ и быстро разрушается в кровотоке; это было подтверждено Vergote et al. (97). Альтернативная гипотеза состоит в том, что обестатин оказывает свое влияние на еду и питье через прямое взаимодействие с желудочно-кишечной системой. Действительно, Zhang et al. (98) наблюдали снижение сократительной активности полосок тощей мышцы in vitro и подавление опорожнения желудка in vivo после лечения обестатином.Таким образом, подавление сокращения тощей кишки может генерировать афферентный блуждающий сигнал, вызывающий чувство сытости в мозге. Недавно Fujimiya et al. (99) предположили, что обестатин может воздействовать на рецептор обестатина на афферентных нервных окончаниях блуждающего нерва, а кортикотропин-рилизинг-фактор (CRF) и урокортин-2 нейроны в гипоталамусе могут опосредовать действие обестатина по подавлению моторики желудочно-кишечного тракта через CRF1-R и CRF2-R в головном мозге (100).
Центральные гипоталамические пептиды
Гипоталамус содержит несколько важных ядер, которые связаны с энергетическим гомеостазом и регуляцией питания.LH - это центр кормления, VMH - центр насыщения, а ARC - интегрированный центр регулирования кормления.
Гипоталамические орексигенные пептиды
Нейропептид Y
ARC является основным сайтом экспрессии NPY в нейронах гипоталамуса, которые проецируются на PVN, дорсомедиальный гипоталамус (DMH), LH и другие участки гипоталамуса. Хотя NPY может оказывать разнообразное воздействие на поведение и другие функции, его наиболее заметным эффектом является стимуляция кормления после центрального введения (101).Синтез NPY в ARC и его высвобождение в PVN, наиболее распространенная проекция, регулируется ингибирующими афферентными сигналами, такими как лептин и инсулин, и стимулирующими сигналами, такими как глюкокортикоиды. Нейроны NPY являются потенциальными мишенями гипоталамуса для лептина и ингибирования синтеза, и, вероятно, высвобождение NPY, по-видимому, частично объясняет способность лептина вызывать гипофагию и потерю веса. Было показано, что инсулин подавляет синтез и секрецию NPY в PVN. Идентифицировано пять рецепторов NPY, связанных с G-белком - Y 1 , Y 2 , Y 4 , Y 5 и Y 6 .Y 5 рецепторы были задействованы как важные рецепторы, которые опосредуют питательные эффекты NPY (102, 103). Рецептор Y 5 экспрессируется на относительно высоких уровнях в LHA, недалеко от сайта, где NPY действует наиболее эффективно, стимулируя питание (104).
Белок, родственный гену агути
Белок, родственный гену агути, представляет собой пептид из 132 аминокислот. Внутри ЦНС AgRP экспрессируется исключительно в ARC, а мРНК AgRP совместно локализуется с мРНК NPY в 95% NPY-положительных клеток в этом ядре (105).Росси и др. показали, что, как и NPY, AgRP является орексигенным пептидом при введении ICV (106) или непосредственно в PVN или DMH (107). Уникальным образом AgRP действует как эндогенный антагонист рецепторов мелакортина-3 (MC3R) и мелакортина-4 (MC4R) (108). Вероятно, AgRP играет модулирующую роль в кормлении. Возможно, что AgRP более важен в условиях высоких энергетических потребностей, таких как беременность и кормление грудью, при которых было показано, что он более выражен (109).
Меланин-концентрирующий гормон
Меланин-концентрирующий гормон - это кислородный циклический 19-аминокислотный нейропептид.В гипоталамусе (MCH) он высоко экспрессируется в LH и zona incerta (110) и оказывает орексигенное действие после инфузии ICV (111). Интерес к эффекторным механизмам, с помощью которых MCH является орексигенным, в основном сосредоточен на рецепторах MCHR1 в оболочке прилежащего ядра (AcbSh), где инъекция MCH снижает нейрональную активность в нейронах со средними шипами (112). Считается, что прилежащее ядро участвует в мотивационных аспектах питания.
Гипокретины / орексины
Гипокретины (1 и 2; также известные как орексины A и B) представляют собой возбуждающие нейропептиды, которые продуцируются в телах клеток в области LH, но имеют обширные проекции во многие области.Гипокретин / орексины связываются с рецепторами орексина 1 и 2 (OXR1 и OXR2), которые возникают из двух отдельных генов. Распределение двух рецепторов различно. В гипоталамусе OX1R наиболее экспрессируется в PVN (113).
Орексины - нейропептиды, стимулирующие аппетит. Тела нейронных клеток орексина присутствуют в ЛГ и ДМГ, а нейрональные волокна, содержащие орексин, распределены в нескольких ядрах с многочисленными выступами в сторону ARC. Орексин-содержащие нейроны проецируются на NPY-содержащие нейроны в ARC, а NPY-нейроны экспрессируют OX1R (114).Кроме того, орексины увеличивают цитозольную концентрацию Ca 2+ в нейронах NPY, выделенных из ARC (115). Эти результаты показывают, что нейроны NPY получают возбуждающие сигналы от нейронов, содержащих орексин, в ЛГ. Распределение двух рецепторов также различно; в гипоталамусе OX1R наиболее высоко экспрессируется в VMH, а OX2R наиболее высоко экспрессируется в PVN (113).
Галанин
Галанин представляет собой амидированный на С-конце 29 аминокислот (30 аминокислот, не амидированный у человека), обнаруженный в мозге и кишечнике.Галанин сосуществует с ГАМК, норадреналином, 5-гидрокситриптамином (5-HT) и NPY в нескольких областях мозга. Гипоталамическая неврология галанина обнаруживается в основном в PVN, супраоптическом ядре гипоталамуса (SON) и ARC. Многие галанин-положительные волокна, а также галанин-положительные нейроны были продемонстрированы в дорсальном комплексе блуждающего нерва, что позволяет предположить, что галанин оказывает свое действие путем вовлечения нейронов блуждающего нерва. Ядро солитарного тракта является основным источником галаниновых окончаний в дорсальном комплексе блуждающего нерва.Существует два клонированных рецептора подтипа галанина: GalR1 и GalR2 в основном распределены в гипоталамусе, PVN, миндалине, гиппокампе, стволе мозга, спинном мозге, периферической нервной системе и других тканях (116). Этот пептид участвует в модуляции обучения, памяти, питания, воспаления, контроля болевого порога, сексуального поведения, высвобождения инсулина и гормонов гипофиза (117–119). Сообщалось, что однократное центральное введение галанина увеличивает потребление жира.
Галанин-подобный пептид
Галанин-подобный пептид (GALP) представляет собой новый пептид, состоящий из 60 аминокислот, причем остатки 9–21 идентичны биологически активной N-концевой (1–13) части галанина (120). Исследования гибридизации in situ показали, что мРНК GALP распределена в перивентрикулярных областях ARC (121, 122) на среднем возвышении и в гипофизе крысы (123). Терминалы аксонов, содержащие NPY, близко расположены (напротив) к нейронам, содержащим GALP, в ARC (124). Более того, Cunningham et al. (125) продемонстрировали, используя гибридизацию с двойной меткой in situ , что GALP-содержащие нейроны в макаках экспрессируют рецептор NPY Y1, предполагая, что NPY регулирует нейроны GALP в ARC.Однако, активирует ли NPY GALP, еще предстоит определить.
Церебеллин 1
Церебеллин1 (Cbln1) высоко экспрессируется в гипоталамусе. ICV-введение Cbln1 увеличивает потребление пищи и высвобождение NPY из гипоталамических эксплантатов и снижает уровни тиреотропного гормона (ТТГ) в плазме крови у крыс после постинъекции без неблагоприятных поведенческих эффектов. Уровни экспрессии мРНК Cbln1 были увеличены в вентромедиальном ядре гипоталамуса у голодных крыс. Эти данные позволяют предположить, что Cbln1 - новый орексигенный пептид, который может опосредовать свои эффекты через гипоталамический NPY (126).
Гипоталамические анорексигенные пептиды
Транскрипт, регулируемый кокаином и амфетамином
Транскрипт, регулируемый кокаином и амфетамином, представляет собой нейропептид, который, по-видимому, является мощным физиологическим анорексическим сигналом. МРНК CART была идентифицирована на основании ее увеличения после лечения кокаином или амфетамином у крыс (127). Пептид CART локализован в определенных областях гипоталамуса, включая перивентрикулярное ядро, дорсомедиальное ядро, перифорникальные области, латеральное ядро и ARC.В PVN мРНК CART совмещена с вазопрессином и CRF-содержащими нейронами (128).
Меланокортины
Меланокортины представляют собой биоактивные пептиды, полученные из молекулы-предшественника POMC посредством тканеспецифичного посттрансляционного расщепления (56). Ген РОМС экспрессируется на физиологически значимых уровнях в ряде тканей млекопитающих, включая передний и промежуточный гипофиз, кожу, иммунную систему и нейроны гипоталамуса. Репертуар продуктов, полученных из POMC любой тканью, определяется специфичностью конвертаз, экспрессируемых в ткани (129, 130).Промежуточная доля гипофиза вырабатывает α-меланоцит-стимулирующий гормон (α-MSH), пептид, который активирует рецепторы меланокортина (MC) 3 и MC4 MC и ингибирует прием пищи. Рецепторы MC3R и MC4R обнаружены в областях, которые, как известно, участвуют в регулировании энергетического баланса, но также и в других областях, таких как кора головного мозга и гиппокамп. Биоактивные пептиды, генерируемые в нейронах гипоталамуса, действуют как эндогенные лиганды для MC4R, ключевой молекулы, лежащей в основе контроля аппетита и энергетического гомеостаза (131).
Глюкагоноподобные пептиды
В головном мозге высвобождение GLP-1 в ядре NTS солитарного тракта и из проекций нейронов GLP-1 на PVN приводит к активации рецептора GLP-1, что способствует насыщению и анорексии. Активированные нейроны GLP-1 NTS также проецируются на ARC, чтобы модулировать отток блуждающего мотора к поджелудочной железе и другим тканям, не изображенным, увеличивая секрецию инсулина β-клетками в состоянии гипергликемии и подавляя глюкагон из α-клеток, что приводит к понижение уровня глюкозы в крови.Системный GLP-1 может также проникать в мозг через утечки в BBB, таких как субфорный орган и AP, как было продемонстрировано у крыс. Внутривенное введение GLP-1 нормальным людям и людям с ожирением снижает потребление пищи в зависимости от дозы (132), а также уменьшает опорожнение желудка (133, 134). Считается, что эти эффекты опосредуются путями блуждающего нерва и ствола мозга, поскольку периферическое введение GLP-1 активирует нейроны в стволе головного мозга у крыс (1, 135).
Распределение колокализованного пептида GLP-2 полностью перекрывается с GLP-1 в ЦНС, с самой высокой концентрацией в диффузной вентральной части дорсомедиального ядра (76, 136).При введении в боковой желудочек GLP-2 оказывает заметное ингибирующее действие на питание. Влияние GLP-2 на кормление зависит как от поведения, так и от фармакологии (76). CNS GLP-2R необходим для контроля поведения корма. Делеция Glp-2r в нейронах POMC увеличивает потребление пищи с увеличенной частотой приема пищи и ускоряет опорожнение желудка, предполагая, что GLP-2 в ЦНС является ключевым сигналом насыщения для физиологического краткосрочного контроля пищевого поведения и моторики желудка и способствует долгосрочному гомеостатический контроль энергетического баланса (или массы тела).Более того, активация передачи сигналов GLP-2R подавляет потребление пищи и опорожнение желудка посредством пути передачи сигналов MC4R. Guan et al. (137) результаты показывают, что опорожнение желудка является ключевым процессом для краткосрочного контроля пищевого поведения, а опосредованное нейроном POMC подавление приема пищи может осуществляться за счет замедления опорожнения желудка (137).
Фактор высвобождения кортикотропина
Кортикотропин-рилизинг-фактор или CRH представляет собой нейрогормон млекопитающих, состоящий из 41 аминокислоты, который наиболее известен как главный физиологический регулятор секреции АКТГ гипофизом.CRH сильно экспрессируется в нейронах PVN и при центральном введении подавляет прием пищи и снижает массу тела у крыс. Периферическое введение человеческого CRH увеличивает расход энергии и окисление жиров у человека. Инфузия лептина стимулирует экспрессию CRH, тогда как предварительная обработка антагонистом CRH ослабляет вызванное лептином снижение потребления пищи и массы тела.
Нейротензин
Нейротензин (NT) представляет собой пептид из 13 аминокислот. NT продуцируется в ARC, PVN и DMH гипоталамуса, и его микроинъекция в PVN снижает потребление пищи.NT-нейроны, по-видимому, играют анорексическую роль ниже лептина, поскольку инфузия ICV-лептина в PVN стимулирует синтез NT в сочетании с уменьшением потребления пищи (138, 139). Эти результаты предполагают, что действие лептина может быть опосредовано, по крайней мере частично, NT.
Несфатин-1
В начале 1990-х годов белок был идентифицирован в линиях клеток мыши (140) и человека (141) и назван нуклеобиндином или NEFA (ДНК-связывание / EF-рука / богатая кислотными аминокислотами область). До настоящего времени были идентифицированы два нуклеобиндина, а именно нуклеобиндин1 (NUCB1) и нуклеобиндин2 (NUCB2 или NEFA).NUCB2 содержит 24-аминокислотный N-концевой сигнальный пептид и 396-аминокислотную последовательность, которая является высококонсервативной у грызунов и людей (142), что указывает на его физиологическое значение. NUCB2 был локализован на плазматической мембране и в цитоплазме.
В 2006 году Ох и его коллеги (143) первыми описали, что предполагаемый посттранскрипционный процессинг NUCB2 ферментом прогормон конвертазой (PC) -1/3 приводит к несфатину-1 (аминокислота 1–82), несфатину -2 (аминокислота 85–163) и несфатин-3 (аминокислота 166–396) (143).До сих пор биологическая активность была продемонстрирована только у несфатина-1 и фрагмента несфатина-1 24–53 .
В первоначальном отчете описана экспрессия мРНК NUCB2, подтвержденная иммуногистохимическим анализом несфатина-1, в ядрах гипоталамуса и ствола мозга крыс, участвующих в регуляции пищевого поведения, таких как PVN, супраоптическое ядро, ARC, LH, zona incerta и NTS (143). . Несфатин-1 в иммунопозитивных нейронах совмещен с рядом передатчиков мозга (8, 12-17).
Несфатин-1 напрямую ингибирует нейроны ARC, содержащие NPY. Недавнее исследование предоставило убедительные доказательства участия окситоцинового пути в ингибирующем эффекте несфатина-1 на прием пищи (144). Нефастатин-1 также, вероятно, будет действовать последовательно за счет привлечения центральных MC и сигнальных систем кортикотропин-рилизинг-фактора 2 (CRF 2 ) для снижения потребления пищи. Анорексическое действие периферического несфатина-1 / NUCB2 может быть опосредовано афферентами блуждающего нерва, проецирующимися на ядро солитарного тракта, в дополнение к потенциальному гормональному действию через пересечение ГЭБ (145).
Центральный несфатин-1 / NUCB2 опосредует свой анорексигенный эффект посредством активации передачи сигналов меланокортина 3/4 и CRF 2 , а также посредством гиперполяризующих нейронов, содержащих орексигенный пептид, NPY. Несфатин-1 также активирует магноцеллюлярную окситоцинергическую систему гипоталамуса, что может снизить потребление пищи и задержать опорожнение желудка. Периферический несфатин-1 может достигать головного мозга через кровообращение и пересечение ГЭБ и / или путем прямого воздействия на окжелудочковые органы, а также на модуляцию афферентной активности блуждающего нерва.
Иммуноокрашивание периферических тканей подтвердило экспрессию белка несфатин-1 / NUCB2 в желудке крысы и, кроме того, в эндокринных островках Лангерганса поджелудочной железы, семенниках и гипофизе. Точно так же иммунопозитивные к несфатин-1 клетки эндокринной поджелудочной железы исключительно совместно с инсулином локализуются в β-клетках (146, 147). Эти данные свидетельствуют о дифференциальном высвобождении несфатина-1 и грелина из желудка, а несфатина-1 и инсулина из поджелудочной железы, что требует дальнейшего исследования.Выдающееся и исключительное эндокринное распределение несфатина-1 / NUCB2 в клетках желудка и поджелудочной железы подтверждает тот факт, что несфатин-1 может действовать как пептид между кишечником и мозгом, влияя на потребление пищи и гомеостаз глюкозы. Анорексическое действие периферического несфатина-1 / NUCB2 может быть опосредовано афферентами блуждающего нерва, проецирующимися на ядро солитарного тракта, в дополнение к потенциальному гормональному действию через пересечение ГЭБ (145).
Гормоны гипофиза
Вазопрессин
Вазопрессин значительно снижает потребление пищи в течение 4 часов у экспериментальных животных.Снижение потребления пищи, особенно в первые 30 минут кормления, существенно не нарушается ваготомией, что позволяет предположить, что ее периферический механизм действия отличается от такового у CCK или энтеростатина (148).
Гормон, стимулирующий меланоциты
У желтых мышей со сверхэкспрессией AgRP, получавших меланоцит-стимулирующий гормон (МСГ), наблюдается значительное увеличение потребления пищи и прибавка в весе, что в 30–100 раз больше, чем у ацилированной формы (α) МСГ.Напротив, инъекция αMSH вызывает гораздо более сильное потемнение меланоцитов, чем dMSH.
Гормон роста
После лечения GH у гипофизэктомированных животных увеличивается потребление пищи и увеличивается их рост. Это открытие может быть прямым воздействием гормона роста на центры питания или может быть связано со второй стимуляцией усиленным потоком аминокислот в новые белки, что приводит к увеличению кормления.
Гормон роста стимулирует липолиз в AT и особенно во висцеральных и подкожных депо (149–152).Гормоночувствительная липаза (HSL или LIPE) - важный фермент, участвующий в этом процессе. GH может также модулировать экспрессию связывающего липидные капли белка, CIDE-A (эффектор, вызывающий гибель клеток, подобный DFF45). Белки CIDE связаны с липидными каплями, где они способствуют накоплению липидов и ингибируют липолиз. В отличие от AT, GH индуцирует поглощение FFA в скелетных мышцах путем повышения экспрессии LPL (153, 154). Повторная стерилизация триацилглицеридов (ТАГ) из FFA приводит к образованию промежуточных продуктов, таких как диацилглицерин и церамиды, которые активируют изоформы PKC.PKC может подавлять передачу сигналов инсулина с помощью нескольких механизмов (155, 156). Секреция GH снижается при ожирении, где повышенные уровни FFA могут оказывать подавляющее действие на секрецию GH. Гиперинсулинемия, связанная с этой патологической ситуацией, также может способствовать снижению секреции GH (156). Таким образом, GH-индуцированное увеличение поглощения FFA и синтеза TAG может привести к инсулинорезистентности. Эти данные также предполагают, что GH вызывает сдвиг в использовании субстрата от глюкозы к липидам в скелетных мышцах.
Последствия ожирения и метаболического синдрома
Ожирение
Считается, что этиология ожирения чрезвычайно сложна и включает сочетание избыточных диетических калорий и снижения физической активности
.Пептид: типы и функции - Online Biology Notes
26 января 2018 Гаураб Карки Биохимия 0
- Пептид (пептидная связь) представляет собой амидную связь, образованную реакцией между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты с отщеплением молекулы воды.
- Пептидная связь имеет характер частичной двойной связи, поэтому она короче одинарной связи и длиннее двойной связи.
- Пептидная связка жесткая и удобная.
- Частичная двойная связь пептидной связи, предотвращающая свободное вращение полипептидной цепи.
- Пептидная связь - « транс» Она никогда не встречается в конфигурации « цис» из-за стерических затруднений.
- -COO и -NH группа пептидной связи не ионизируется, но является полярной, поэтому она может образовывать водородную связь при формировании вторичной структуры белков.
Виды пептидов
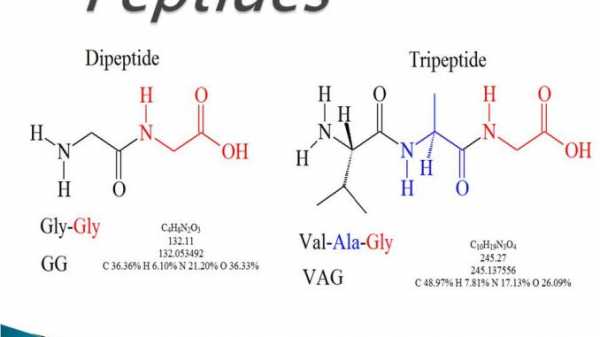
1. Дипептиды:
- Соединение образуется, когда две аминокислоты связаны одной пептидной связью.
- Примеры:
- Карнозин (β-аланил-L-гистидин)
- Ансерин (β-аланил-N-метилгистидин)
- Аспартам (аспарагин-фенилаланин)
2. Трипептиды
- Соединение образуется, когда три аминокислоты связаны двумя пептидными связями.
- Примеры;
- Глутатион (глутамилцистинилглицин)
- Офтальмовая кислота (L-γ-глутамил-α-L-амино-бутирл-глицин)
3. Олигопептиды
- Соединение, образующееся, когда более 2 и менее 20 аминокислот связаны пептидными связями.
- Примеры;
- тетрапептид; Тульфсин (трионин-лизин-пролин-аргинин) ,00
- Эндоморфин-1 (тирозин-пролин-триптофан-фенилаланин)
- Аманитин (декапептид)
- Нетропсин
4. Полипептиды
- Соединение, образующееся, когда более 20 аминокислот связаны пептидной связью.
- Примеры:
- Инсулин
- Гормон роста
Функции пептидов:
- i.Предшественник белка: Пептиды являются предшественником белка.
- ii. Как алкалоиды: Пептиды также входят в состав алкалоидов (алкалоиды - это группа вторичных метаболитов, таких как никотин, кофеин, терпентин, эрготамин и т. Д.).
- iii. В качестве антимикробного средства: Пептиды обладают антибактериальными свойствами. Вторичные метаболиты бактерий и грибов обладают антимикробной активностью. Например. Пенициллин G (валин-цистеин-фенилуксусная кислота) ,00
- iv.Как гормоны: Пептиды действуют как гормоны, например. Инсулин, соматостатин, вазопрессин и т. Д.
- v. Пептиды также действуют как факторы роста . Например. Аскорбиновая кислота (вит. С)
- vi. Как антиоксидант: пептид действует как антиоксидант. Они удаляют свободные радикалы. Например. Карнозин
- vii. Клинический диагноз: гиперсекреция пептида с мочой является индикатором психического расстройства, такого как депрессия, шизофрения и т. Д.
- viii.Как структурный компонент: пептидов образуют длинные цепи, создавая структурный белок, который обеспечивает поддержку организма. Например. Кератин, коллаген
Пептид: типы и функции
.Антигипертензивные пептиды из пищевых белков
Регуляция АД сложна и включает множество взаимосвязанных метаболических путей. Безусловно, наиболее изученные пути контроля АД в отношении пептидов пищевого происхождения включают те, которые, как было показано, ингибируют ACE in vitro . Этот фермент является одним из основных регуляторов АД и участвует в двух основных системах: системе ренин-ангиотензин (RAS) и системе кинин-оксид азота (KNOS). Ингибирование АПФ в этих системах приводит к расширению стенок артерий или расширению сосудов и последующему снижению АД.Однако пока неизвестно, является ли это основным механизмом, который следует за in vivo , или есть ряд других задействованных механизмов контроля АД [4].
2.1. Ингибирование АПФ
Ингибирование АПФ является отличной физиологической мишенью для клинического лечения гипертонии из-за его участия в двух связанных с АП системах, RAS и KNOS. Считается, что RAS является одной из преобладающих прессорных систем в контроле АД. В РАС N-конец прогормона ангиотензиногена, который происходит из печени, расщепляется почечным ренином с образованием декапептида ангиотензина I (Ang I).Затем ACE удаляет C-концевой дипептид HL с образованием Ang II, мощного вазоконстрикторного пептида, который действует непосредственно на гладкомышечные клетки сосудов. Таким образом, ингибирование АПФ, как следствие, приводит к снижению АД. Ang II связывается с рецепторами AT 1 и AT 2 , которые расположены в периферических тканях вокруг тела и в головном мозге. Сужение сосудов, вызываемое Ang II, опосредуется рецептором AT 1 . [5-7]. В KNOS АПФ инактивирует сосудорасширяющие пептиды брадикинин и каллидин.Каллидин синтезируется из кининогена калликреином, и его дальнейшее действие на каллидин приводит к образованию брадикинина среди других вазоактивных пептидов. Брадикинин связывается с β-рецепторами, что в конечном итоге приводит к повышению внутриклеточного уровня Ca 2+ . Связывание брадикинина с β-рецепторами и увеличение Ca 2+ стимулирует синтазу оксида азота (NOS) для преобразования L-аргинина в оксид азота (NO), мощное сосудорасширяющее средство. Следовательно, АПФ может косвенно ингибировать продукцию NO, поскольку он гидролизует брадикинин до неактивных фрагментов [7].
В настоящее время на рынке представлен ряд широко используемых синтетических ингибиторов АПФ, которые служат первой линией подхода к лечению гипертонии. К таким ингибиторам относятся каптоприл, эналаприл и лизиноприл. Однако их использование связано с рядом побочных эффектов, включая кашель, кожную сыпь, гипотензию, потерю вкуса, ангиодемическое снижение функции почек и аномалии плода [8]. Природные пептиды, ингибирующие АПФ, из пищи не связаны с побочными эффектами, вызываемыми синтетическими лекарствами.Они не являются такими мощными ингибиторами АПФ, как синтетические ингибиторы, которые могут иметь значения IC 50 в области нМ. Поскольку они в меньшей степени ингибируют АПФ, это потенциально обеспечивает более безопасный уровень брадикинина в организме. Таким образом, по этой причине пептиды, ингибирующие АПФ, вызывают интерес как потенциальные профилактические средства для контроля гипертонии.
Пептиды, ингибирующие АПФ, были идентифицированы в ряде пищевых белков, включая казеин, сыворотку, овальбумин, красные водоросли, вакаме, сою, желатин, куриные мышцы, сушеную бонито, кукурузу, сардины, рапс, картофель, нут, мышцы тунца. , альбумин гороха, чеснок, зародыши пшеницы, саке, гемоглобин свиньи и кальмары.Пептиды, ингибирующие АПФ, обнаруженные в различных пищевых белках, были тщательно изучены (обзор см. В [9-12; 3; 131]. Примеры недавно опубликованных источников пептидов, ингибирующих АПФ пищевых белков, включают гольц ( Misgurnus anguillicaudatus ) [13], свинину мясо [14], фасоль лима ( Phaseolus lunatus) [15], кожа ската [16] и мясо куриных окорочков без костей [17]. Пептиды, ингибирующие АПФ, генерируются различными способами. Они могут вырабатываться естественным путем во время пищеварение желудочно-кишечного тракта (ЖКТ) за счет гидролитического действия протеиназ пепсина, трипсина, химотрипсина и пептидаз щеточной каймы [18].Моделирование пищеварения желудочно-кишечного тракта проводилось на ряде источников белка для оценки влияния переваривания желудочно-кишечного тракта на пептиды, ингибирующие АПФ [19-24]. Чаще всего пептиды, ингибирующие АПФ, производятся посредством ферментативного гидролиза ферментами GI, такими как пепсин и трипсин, или комбинациями ферментов, такими как Alcalase ™ [25]. Пептиды, ингибирующие АПФ, также производились во время ферментации молока при производстве сыра. Было показано, что штаммы Lactobacillus и Lactococcus lactis продуцируют пептиды, ингибирующие АПФ.Кроме того, было обнаружено, что ферментированные соевые продукты, такие как соевая паста, соевый соус, натто и темпе, вырабатывают пептиды, ингибирующие АПФ [26-29].
Пептиды, ингибирующие АПФ, могут работать тремя способами и классифицируются как тип ингибитора, тип субстрата или тип пролекарства на основании изменений ингибирующей активности АПФ после гидролиза пептидов АПФ [30]. Пептиды ингибиторного типа представляют собой пептиды, ингибирующие АПФ, активность которых существенно не изменяется, поскольку пептиды устойчивы к расщеплению АПФ.Ингибиторы АПФ субстратного типа показывают снижение активности АПФ из-за расщепления АПФ. Тип пролекарства относится к превращению в сильные ингибиторы АПФ после гидролиза более крупных пептидных фрагментов самим АПФ. Полученные пептиды имеют тенденцию вызывать длительные гипотензивные эффекты in vivo [30]. Ингибитор АПФ пролекарственного типа был выделен из термолизинового гидролизата Katsuo-bushi, традиционного японского продукта питания, обработанного из сушеного скумбрии. В исследовании сообщается о 8-кратном увеличении ингибирующей активности АПФ, когда пептид Leu-Lys-Pro-Asn-Met (IC 50 = 2.4 мкМ) гидролизовали АПФ с получением Leu-Lys-Pro [IC 50 = 0,32 мкМ; 30]. Когда Leu-Lys-Pro-Asn-Met и Leu-Lys-Pro вводились перорально крысам со спонтанной гипертензией (SHR), Leu-Lys-Pro-Asn-Met демонстрировал максимальное снижение АД через 4 и 6 часов, что привело к сопоставимы с ингибированием каптоприла. Однако максимальный гипотензивный эффект Leu-Lys-Pro наблюдался через 2 часа [30].
Ингибирование АПФ на сегодняшний день является наиболее изученным механизмом контроля АД в отношении биологически активных пептидов пищевого происхождения.Было обнаружено, что большинство пептидов до некоторой степени ингибируют АПФ. Однако в большинстве случаев еще предстоит ответить, используется ли этот механизм BP in vivo . Существуют и другие регуляторные пути контроля АД, не зависящие от АПФ, которые также являются потенциальными мишенями для действия антигипертензивных пептидов (см. Рисунок 1, где показаны вазорелаксирующие пептиды и молекулы).
Рисунок 1.
Вазорелаксирующие пептиды и молекулы в системах контроля артериального давления.
2.4. Сосудорасширяющее действие опиоидного пептида
Было обнаружено, что пептиды пищевого происхождения также являются источниками опиоидной активности. Эти пептиды связываются с опиоидными рецепторами, вызывая морфиноподобные эффекты. Природные опиоидные пептиды включают эндорфины, энкефалины и динорфины. У человека опиоидные рецепторы обнаруживаются в нервной, эндокринной и иммунной системах, а также в кишечном тракте. Эти рецепторы могут участвовать в различных регуляторных процессах в организме, включая регуляцию кровообращения, что может влиять на АД [37; 38].Nurminen и др. [39] обнаружили антигипертензивный эффект при пероральном введении тетрапептида, α-лакторфина (Tyr-Gly-Leu-Phe), крысам SHR и нормотензивным крысам Wistar Kyoto (WKY). Максимальное снижение АД было обнаружено у SHR со снижением систолического АД (САД) и диастолического АД (ДАД) на 23 ± 4 и 17 ± 4 мм рт. Однако снижение АД, вызванное α-лактофином, не было обнаружено после введения специфического антагониста опиоидных рецепторов, налоксона. Поэтому антигипертензивный эффект считался результатом взаимодействия с опиоидными рецепторами.В последующем исследовании изучалось влияние α-лактофина и второго пептида β-лакторфина, полученного из молока (Tyr-Leu-Leu-Phe), на функцию мезентериальных артерий, чтобы продемонстрировать регуляторные механизмы действия. Было показано, что с ингибитором NOS N G -нитро-L-аргинина метиловым эфиром (L-NAME) α-лактофин вызывает эндотелий-зависимую вазорелаксацию, тогда как β-лакторфин также усиливает эндотелий-независимую вазорелаксацию. В исследовании сделан вывод, что α-лактофин может стимулировать опиоидные рецепторы, которые, в свою очередь, высвобождают NO, вызывая вазорелаксирующий эффект [40].Сообщалось также, что производный казеина пептид казоксин D (Tyr-Val-Pro-Phe-Pro-Pro-Phe) обладает гипотензивным действием через опиоидные рецепторы. Было обнаружено, что пептид имеет эндотелий-зависимую релаксацию в полосках брыжеечной артерии собаки. Антиопиоидный и вазорелаксирующий эффекты опосредуются опиоидным µ-рецептором и BK B1-рецептором соответственно [41–42]. Кроме того, было высказано предположение, что индуцированная опиоидами регуляция АД такими пептидами может воздействовать на рецепторы в кишечном тракте. Интересно, что это означало бы, что пептид не должен абсорбироваться в кровоток через мембрану щеточной каймы [43].Вполне возможно, что опиоидное снижение АД может быть основным механизмом антигипертензивных пептидов.
2,5. Ингибирование эндотелин-1 и эндотелин-превращающего фермента (ECE)
Вазоконстрикторный пептид эндотелин-1 (ET-1) высвобождается из большого эндотелина-1 (большого ET-1) под действием эндотелин-превращающего фермента (ECE). ЕТ-1 опосредует сужение сосудов через 2 рецептора, ЕТа и. ETb. Оба рецептора опосредуют сокращения гладких мышц, но ETb также вызывает расслабление эндотелиальных клеток за счет производства оксида азота.Известно, что ЕТ-1 обладает более сильным сосудосуживающим эффектом, чем Ang II [44; 7]. Было обнаружено, что эндотелиально-зависимое высвобождение NOS является механизмом действия антигипертензивного пептида овокинина (f2-7) яичного белка (Arg-Ala-Asp-His-Pro-Phe). Было обнаружено, что расширение изолированных брыжеечных артерий SHR ингибируется L-NAME, но не индометацином, что демонстрирует высвобождение NO из эндотелиальных клеток [45]. Более позднее исследование показало, что овокинин (2–7) модулирует гипотензивный эффект посредством взаимодействия через рецепторы брадикинина B 2 [46].
Было обнаружено, что пищевые белки обладают способностью действовать как ингибиторы ECE. Okitsu и др. [47] обнаружили пептиды, ингибирующие ЕЭК, в пепсиновом переваривании говядины и пиролизного аппендикса бонито. До 45 и 40% активности ECE можно было ингибировать с помощью пептидов говядины и бонито, соответственно. Второе исследование показало, что ингибирующий АПФ пептид Ala-Leu-Pro-Met-His-Ile-Arg, высвобождаемый при триптическом расщеплении бычьего β-лактоглобулина, может ингибировать высвобождение ЕТ-1 в культивируемых эндотелиальных клетках аорты свиньи (PAECs ).При концентрации 1 мМ Ala-Leu-Pro-Met-His-Ile-Arg высвобождение ЕТ-1 снижалось на 29%. В исследовании сделан вывод о том, что снижение ЕТ-1 может быть связано с косвенным снижением высвобождения ЕТ за счет ингибирования АПФ через путь ВК, а не прямым действием пептида на ЕТ-1 [48]. ACE разбивает BK на неактивные фрагменты в KNOS. Последующее накопление BK (вазодилататора) из-за ингибирования АПФ приводит к повышенному высвобождению вазодилататора NO и препятствует высвобождению ЕТ-1 эндотелиальными клетками.
.