В каких продуктах тиаминаза
Витамин В1 (тиамин) где содержится
1 499Витамины и минералы можно получать как из пищи, так и из витаминных комплексов. Естественно что первый вариант предпочтительней. А в случае с тиамином еще и не очень сложная задача, так как этот витамин присутствует в достаточно большом списке продуктов. Так как сегодня мы говорим о тиамине, то витамин В1 (тиамин) где содержится в продуктах?
Итак, в каких продуктах содержится тиамин? Какие концентрации тиамина (Витамин В1) в продуктах питания (таблица)? Все это можно узнать ниже в статье.
Тиамин где содержится
В основном тиамин присутствует в растительной пище. Есть он и в продуктах животного происхождения, но в гораздо меньших объемах. Молоко, молочные продукты и фрукты бедны на данный витамин. В растительных маслах тиамин не присутствует вообще. Также данный витамин производят многие микроорганизмы, например кишечная палочка в нашем организме, которая живет у нас в толстом кишечнике, но там не происходит всасывания и весь выработанный палочкой тиамин выходит из организма с отходами.
В каких продуктах содержится тиамин
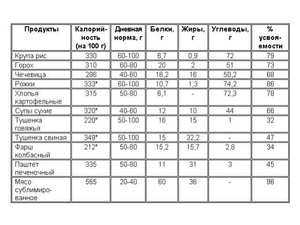
Основными продуктами где присутствует тиамин являются: пивные дрожжи, пшеница, ячмень, рожь, неочищенный рис, фасоль, горох, отруби, семечки подсолнуха, кедровые и грецкие орехи, миндаль, фисташки, свинина и куриные субпродукты (печень).
Из готовых продуктов: хлеб и макароны из муки грубого помола, с добавлением отрубей.

Источники витамина В1 — тиамин
Содержание витамина В1 (тиамин) в продуктах:
| в мг. на 100 г. продукта | в мг. на 100 г. продукта | ||
|---|---|---|---|
| Дрожжи пивные | 20 | Фундук | 0,5 |
| Бурый рис | 2,3 | Рис неочищенный | 0,4 |
| Семечки подсолнуха (сырые) / жареные | 1,6 / 0,1 | Рожь | 0,4 |
| Семя льна | 1,6 | Кукуруза | 0,4 |
| Кедровые орешки | 1,2 | Орехи грецкие | 0,4 |
| Фисташки (сырые) | 0,9 | Ячмень | 0,3 |
|
| ||
Кунжут:
| |||
| Арахис | 0,8 | Макароны | 0,3 |
Отруби:
| Миндаль | 0,3 | |
| Овсяная крупа | 0,6 | Чеснок | 0,2 |
Травы:
| Желток | 0,2 | |
|
| ||
| Кешью | 0,5 | Хлеб ржаной | 0,2 |
| Гречка | 0,5 | Морковь | 0,1 |
| Хлеб с отрубями | 0,5 | Картофель | 0,1 |
Тиамин в продуктах питания очень распространен и присутствует во многих рационах питания, но его организму нужно много и постоянно — так что лучше в течении дня употреблять продукты содержащие В1 небольшими порциями, чем за раз съесть всю дневную норму — излишки все равно выведутся организмом без усвоения.
Больше о витамине В1, единицах его измерения, его дефиците, передозировке, суточной норме потребления, противопоказаниях, побочных явлениях и другом читайте на нашем сайте.
Тиаминаза и - Большая Химическая Энциклопедия
Соединения, естественно присутствующие в пищевых продуктах, могут обладать антивитаминной активностью. Многие пищевые продукты содержат тиаминазы и соединения, которые катализируют неферментативное расщепление тиамина до биологически неактивных продуктов (раздел 6.4.7). [Стр.9]Эванс, WC. Тиаминазы и их действие на животных. В Munson PL, Glover J, Diczfalusy U, et al, eds. Витамины и гормоны. New York Academic Press, ... [Pg.1148]
Evans WC (1975) Тиаминазы и их влияние на животных.Vitam Horm 33 467-504 Faivre M, Saif N, Barral C (1975) Несчастные случаи с витамином Bi2 - Lyon Med 233 897-993 Feinberg SM (1948) Анафилактический шок из-за никотиновой кислоты. NY State J Med 48 635 Fisher AA (1975) Контактный дерматит у хирургов. J Dermatol Surg 1 63-67 Fishman L, Goldstein M (1968) Витамины в дерматологии. J Med Assoc Ga 57 342-346 Folkers K (1969) Обзор витаминных аспектов коэнзима Q. Int J Vitam Nutr Res 39 334-352 ... [Pg.686]
Токсопиримидин (пирамин 1010) может быть получен из тиамин (витамин Bi 1011) путем кислотного гидролиза или путем обработки тиаминазой Bacillus aneurinolyticus.Токсопиримидин вызывает судороги и смерть у грызунов, как и его аналоги, например 2,4-диметилпиримидин-5-илметанол (1012) (65JMC750), но эффект минимизирован или даже ... [Pg.149]
Некоторые виды рыб и ракообразных содержат тиаминазы. Эти ферменты расщепляют тиамин и, таким образом, инактивируют витамин. Некоторые растительные фенолы, например, хлорогеновая кислота, также могут обладать антитиаминными свойствами, хотя механизм их действия до сих пор недостаточно изучен. [Pg.1288]
Evans, W. C. 1976.Нейротоксические синдромы, опосредованные тиаминазой папоротника. Страницы 113-131 в E. H. Perring и B.G. Gardiner (ред.), Биология папоротника. Линнеевское общество Лондонской академической прессы, Лондон. [Pg.311]
Термины 3 и E указывают на гидрофобные и стерические эффекты, специфичные для m-заместителей. Уравнение 10 описывает влияние заместителей на скорость переноса замещенных анилинов, катализируемую вице-тиаминазой карпа 11 ... [Pg.124]
Подобное расщепление катализируется разлагающими тиамин ферментами, известными как тиаминазы, которые обнаруживаются у ряда бактерий, морские организмы и растения.[Pg.731]
Витамеры тиамина относительно стабильны в высушенном состоянии при низкой температуре в темноте (67-69). В растворе они обычно нестабильны при повышенных температурах или в щелочных условиях. Тиамин устойчив к нагреванию, включая автоклавирование, и окислению при pH ниже 5,0. Наиболее стабилен при pH 2-4. В растворе TPP стабилен при pH 2-6, если он хранится при низкой температуре. Витамеры тиамина также подвержены разложению эндогенными ферментами тиаминазы и другим тиамином... [Pg.408]
Два аналога тиамина, окситиамина и пиритиамина являются сильнодействующими антиметаболитами и широко используются для индукции дефицита тиамина у экспериментальных животных. Механизмы действия пиритиамина, окситиамина и тиаминаз, обнаруженных в пищевых продуктах, обсуждаются в Разделе 6.4.7. [Стр.150]
Тиаминолитические ферменты обнаружены в различных микроорганизмах и пищевых продуктах, а ряд термостабильных соединений, присутствующих в пищевых продуктах (особенно полифенолы), вызывают окислительное расщепление тиамина, как и сульфит, который широко используется в пищевой промышленности.Продукты расщепления тиамина сульфитом и тиаминазами показаны на рисунке 6.1. [Pg.166]
У людей, потребление тиамина которых незначительно, колонизация желудочно-кишечного тракта тиаминолитическими микроорганизмами может быть фактором развития авитаминоза. Тиаминазы, присутствующие в сырой рыбе, могут привести к так называемому параличу Частека у лисиц и норок в результате разрушения тиамина и могут иметь важное значение в тех частях мира, где большая часть очевидного потребления тиамина происходит из рыбы, которую едят сырой. или ферментированный.Полифенолы и тиаминаза в папоротнике папоротника могут вызывать дефицит тиамина (слепое шатание) у лошадей, а дубильная кислота в чае и орехах бетеля связана с дефицитом тиамина у человека. [Стр.166]
Тиаминаза II катализирует простой гидролиз, высвобождая тиазол и мет-оксипиримидин, который обладает некоторой антивитаминной активностью, антиметаблоком. Это относительно редко и ограничивается небольшим количеством микроорганизмов. [Pg.166]
Эдвин Э. и Джекман Р. (1970) Тиаминаза I в развитии цереброкортикального некроза у овец и крупного рогатого скота.Nature 228, 772-4. [Pg.423]
Существует два класса тиаминаз. Тиаминаза I катализирует реакцию обмена оснований между тиазольным фрагментом тиамина и различными основаниями, обычно первичными, вторичными или третичными аминами, но также никотинкимидом и другими производными пиридина, а иногда и сульфгидрильными соединениями пролина и тмд. Тиаминаза I относительно широко распространена в большом количестве микроорганизмов, растений и рыб. В дополнение к истощению тиамина, продукты обмена оснований, катедизируемые тиаминазой I, представляют собой структурированные эмедоги витейина и могут иметь антагонистические эффекты (Edwin and Jackman, 1970).Точно так же нейротоксические эффекты антибиотика метронидазола, который представляет собой тиазол, могут быть связаны с его активностью в качестве субстрата для тииминазы I, образующей антиметаболиты тиамина (Alston emd Abeles, 1987). [Стр.166]
.
тиаминаз - Большая химическая энциклопедия
Токсопиримидин (пирамин 1010) может быть получен из тиамина (витамин Bi 1011) путем кислотного гидролиза или путем обработки тиаминазой Bacillus aneurinolyticus. Токсопиримидин вызывает судороги и смерть у грызунов, как и его аналоги, например 2,4-диметилпиримидин-5-илметанол (1012) (65JMC750), но эффект минимизирован или даже ... [Стр.149]Некоторые виды рыб и ракообразных содержат тиаминазы. Эти ферменты расщепляют тиамин и, таким образом, инактивируют витамин.Некоторые растительные фенолы, например, хлорогеновая кислота, также могут обладать антитиаминными свойствами, хотя механизм их действия до сих пор недостаточно изучен. [Pg.1288]
Evans, W. C. 1976. Нейротоксические синдромы, опосредованные тиаминазой Бракена. Страницы 113-131 в E. H. Perring и B.G. Gardiner (ред.), Биология папоротника. Линнеевское общество Лондонской академической прессы, Лондон. [Pg.311]
Особенность тиамина состоит в том, что витамин легко деактивируется. Ранний случай был замечен в 1941 году, когда коммерчески выращиваемая норка была парализована (паралич Chastek), заболевание, которое можно было вылечить, дав животным тиамин.Проблема заключалась в том, что их кормили рыбой, которая частично разложилась. Более поздние исследования показали, что в разложившейся рыбе выделяется микробный фермент тиаминаза, который разрушает тиамин, обычно присутствующий в пище. Совсем другой процесс происходит, когда лошадям или коровам разрешают пастись на папоротнике. Он содержит белок, который связывается с тиамином, что снижает его доступность. И снова это состояние можно вылечить с помощью приема витамина. [Стр.28]
Термины 3 и E указывают на гидрофобные и стерические эффекты, специфичные для m-заместителей.Уравнение 10 описывает влияние заместителей на скорость переноса замещенных анилинов, катализируемую вице-тиаминазой карпа 11 ... [Pg.124]
Подобное расщепление катализируется разлагающими тиамин ферментами, известными как тиаминазы, которые обнаруживаются у ряда бактерий, морские организмы и растения. [Pg.731]
Витамеры тиамина относительно стабильны в высушенном состоянии при низкой температуре в темноте (67-69). В растворе они обычно нестабильны при повышенных температурах или в щелочных условиях.Тиамин устойчив к нагреванию, включая автоклавирование, и окислению при pH ниже 5,0. Наиболее стабилен при pH 2-4. В растворе TPP стабилен при pH 2-6, если он хранится при низкой температуре. Витамеры тиамина также подвержены деградации эндогенными ферментами тиаминазы и другим тиамином ... [Pg.408]
Тиамин Черника, рыба Корма, содержащие тиаминазы ... [Pg.66]
Соединения, естественно присутствующие в пищевых продуктах, могут иметь антивитамины. деятельность. Многие пищевые продукты содержат тиаминазы и соединения, которые катализируют неферментативное расщепление тиамина до биологически неактивных продуктов (Раздел 6.4.7). [Pg.9]
Два аналога тиамина, окситиамина и пиритиамина являются сильнодействующими антиметаболитами и широко используются для индукции дефицита тиамина у экспериментальных животных. Механизмы действия пиритиамина, окситиамина и тиаминаз, обнаруженных в пищевых продуктах, обсуждаются в Разделе 6.4.7. [Стр.150]
Тиаминолитические ферменты обнаружены в различных микроорганизмах и пищевых продуктах, а ряд термостабильных соединений, присутствующих в пищевых продуктах (особенно полифенолы), вызывают окислительное расщепление тиамина, как и сульфит, который широко используется в пищевой промышленности.Продукты расщепления тиамина сульфитом и тиаминазами показаны на рисунке 6.1. [Pg.166]
У людей, потребление тиамина которых незначительно, колонизация желудочно-кишечного тракта тиаминолитическими микроорганизмами может быть фактором развития авитаминоза. Тиаминазы, присутствующие в сырой рыбе, могут привести к так называемому параличу Частека у лисиц и норок в результате разрушения тиамина и могут иметь важное значение в тех частях мира, где большая часть очевидного потребления тиамина происходит из рыбы, которую едят сырой. или ферментированный.Полифенолы и тиаминаза в папоротнике папоротника могут вызывать дефицит тиамина (слепое шатание) у лошадей, а дубильная кислота в чае и орехах бетеля связана с дефицитом тиамина у человека. [Стр.166]
Тиаминаза II катализирует простой гидролиз, высвобождая тиазол и мет-оксипиримидин, который обладает некоторой антивитаминной активностью, антиметаблоком. Это относительно редко и ограничивается небольшим количеством микроорганизмов. [Pg.166]
Эдвин Э. и Джекман Р. (1970) Тиаминаза I в развитии цереброкортикального некроза у овец и крупного рогатого скота.Nature 228, 772-4. [Pg.423]
Существует два класса тиаминаз. Тиаминаза I катализирует реакцию обмена оснований между тиазольным фрагментом тиамина и различными основаниями, обычно первичными, вторичными или третичными аминами, но также никотинкимидом и другими производными пиридина, а иногда и сульфгидрильными соединениями пролина и тмд. Тиаминаза I относительно широко распространена в большом количестве микроорганизмов, растений и рыб. В дополнение к истощению тиамина, продукты обмена оснований, катедизируемые тиаминазой I, представляют собой структурированные эмедоги витейина и могут иметь антагонистические эффекты (Edwin and Jackman, 1970).Точно так же нейротоксические эффекты антибиотика метронидазола, который представляет собой тиазол, могут быть связаны с его активностью в качестве субстрата для тииминазы I, образующей антиметаболиты тиамина (Alston emd Abeles, 1987). [Стр.166]
.
Тиаминаза - Большая химическая энциклопедия
Токсопиримидин (пирамин 1010) может быть получен из тиамина (витамин Bi 1011) путем кислотного гидролиза или путем обработки тиаминазой Bacillus aneurinolyticus. Токсопиримидин вызывает судороги и смерть у грызунов, как и его аналоги, например 2,4-диметилпиримидин-5-илметанол (1012) (65JMC750), но эффект минимизирован или даже ... [Стр.149]Некоторые виды рыб и ракообразных содержат тиаминазы. Эти ферменты расщепляют тиамин и, таким образом, инактивируют витамин.Некоторые растительные фенолы, например, хлорогеновая кислота, также могут обладать антитиаминными свойствами, хотя механизм их действия до сих пор недостаточно изучен. [Pg.1288]
Evans, W. C. 1976. Нейротоксические синдромы, опосредованные тиаминазой Бракена. Страницы 113-131 в E. H. Perring и B.G. Gardiner (ред.), Биология папоротника. Линнеевское общество Лондонской академической прессы, Лондон. [Pg.311]
Особенность тиамина состоит в том, что витамин легко деактивируется. Ранний случай был замечен в 1941 году, когда коммерчески выращиваемая норка была парализована (паралич Chastek), заболевание, которое можно было вылечить, дав животным тиамин.Проблема заключалась в том, что их кормили рыбой, которая частично разложилась. Более поздние исследования показали, что в разложившейся рыбе выделяется микробный фермент тиаминаза, который разрушает тиамин, обычно присутствующий в пище. Совсем другой процесс происходит, когда лошадям или коровам разрешают пастись на папоротнике. Он содержит белок, который связывается с тиамином, что снижает его доступность. И снова это состояние можно вылечить с помощью приема витамина. [Стр.28]
Термины 3 и E указывают на гидрофобные и стерические эффекты, специфичные для m-заместителей.Уравнение 10 описывает влияние заместителей на скорость переноса замещенных анилинов, катализируемую вице-тиаминазой карпа 11 ... [Pg.124]
Подобное расщепление катализируется разлагающими тиамин ферментами, известными как тиаминазы, которые обнаруживаются у ряда бактерий, морские организмы и растения. [Pg.731]
Витамеры тиамина относительно стабильны в высушенном состоянии при низкой температуре в темноте (67-69). В растворе они обычно нестабильны при повышенных температурах или в щелочных условиях.Тиамин устойчив к нагреванию, включая автоклавирование, и окислению при pH ниже 5,0. Наиболее стабилен при pH 2-4. В растворе TPP стабилен при pH 2-6, если он хранится при низкой температуре. Витамеры тиамина также подвержены деградации эндогенными ферментами тиаминазы и другим тиамином ... [Pg.408]
Тиамин Черника, рыба Корма, содержащие тиаминазы ... [Pg.66]
Соединения, естественно присутствующие в пищевых продуктах, могут иметь антивитамины. деятельность. Многие пищевые продукты содержат тиаминазы и соединения, которые катализируют неферментативное расщепление тиамина до биологически неактивных продуктов (Раздел 6.4.7). [Pg.9]
Два аналога тиамина, окситиамина и пиритиамина являются сильнодействующими антиметаболитами и широко используются для индукции дефицита тиамина у экспериментальных животных. Механизмы действия пиритиамина, окситиамина и тиаминаз, обнаруженных в пищевых продуктах, обсуждаются в Разделе 6.4.7. [Стр.150]
Тиаминолитические ферменты обнаружены в различных микроорганизмах и пищевых продуктах, а ряд термостабильных соединений, присутствующих в пищевых продуктах (особенно полифенолы), вызывают окислительное расщепление тиамина, как и сульфит, который широко используется в пищевой промышленности.Продукты расщепления тиамина сульфитом и тиаминазами показаны на рисунке 6.1. [Pg.166]
У людей, потребление тиамина которых незначительно, колонизация желудочно-кишечного тракта тиаминолитическими микроорганизмами может быть фактором развития авитаминоза. Тиаминазы, присутствующие в сырой рыбе, могут привести к так называемому параличу Частека у лисиц и норок в результате разрушения тиамина и могут иметь важное значение в тех частях мира, где большая часть очевидного потребления тиамина происходит из рыбы, которую едят сырой. или ферментированный.Полифенолы и тиаминаза в папоротнике папоротника могут вызывать дефицит тиамина (слепое шатание) у лошадей, а дубильная кислота в чае и орехах бетеля связана с дефицитом тиамина у человека. [Стр.166]
Тиаминаза II катализирует простой гидролиз, высвобождая тиазол и мет-оксипиримидин, который обладает некоторой антивитаминной активностью, антиметаблоком. Это относительно редко и ограничивается небольшим количеством микроорганизмов. [Pg.166]
Эдвин Э. и Джекман Р. (1970) Тиаминаза I в развитии цереброкортикального некроза у овец и крупного рогатого скота.Nature 228, 772-4. [Pg.423]
Существует два класса тиаминаз. Тиаминаза I катализирует реакцию обмена оснований между тиазольным фрагментом тиамина и различными основаниями, обычно первичными, вторичными или третичными аминами, но также никотинкимидом и другими производными пиридина, а иногда и сульфгидрильными соединениями пролина и тмд. Тиаминаза I относительно широко распространена в большом количестве микроорганизмов, растений и рыб. В дополнение к истощению тиамина, продукты обмена оснований, катедизируемые тиаминазой I, представляют собой структурированные эмедоги витейина и могут иметь антагонистические эффекты (Edwin and Jackman, 1970).Точно так же нейротоксические эффекты антибиотика метронидазола, который представляет собой тиазол, могут быть связаны с его активностью в качестве субстрата для тииминазы I, образующей антиметаболиты тиамина (Alston emd Abeles, 1987). [Стр.166]
.
Метаболизм и регуляция витамина B1 (тиамина) у архей
1. Введение
Тиамин или витамин B1 состоит из тиазол / тиазолиевого кольца [5- (2-гидроксиэтил) -4-метилтиазол, THZ], связанного метиленовым мостиком с аминопиримидиновое кольцо (2-метил-4-амино-5-гидроксиметилпиримидин, HMP) (рис. 1A). Тиаминдифосфат (ThDP) - наиболее известная форма тиамина, поскольку он является кофактором. Другие природные производные тиаминфосфата включают: тиаминмонофосфат (ThMP), тиаминтрифосфат (ThTP), аденозинтиаминтрифосфат (AThTP) и аденозинтиаминдифосфат (AThDP) (Рисунок 1A) [1, 2].Эти последние формы еще предстоит проанализировать у архей и, следовательно, не будут предметом рассмотрения в данном обзоре.
Рисунок 1.
Тиамин (витамин B1) и его природные формы. A) Тиамин и его природные производные тиаминмонофосфат (ThMP), тиаминдифосфат (ThDP), тиаминтрифосфат (ThTP) и аденозинтиаминтрифосфат (AdThTP). Аминопиримидиновое кольцо (синий), тиазолиевое кольцо (красный) и метиленовый мостик (зеленый) выделены углеродом, обозначенным буквой C или синими шариками. B) Тиаминдифосфат и его анион / илидная форма C2 (ThDP-).Связанный с ферментом ThDP находится в V-конформации, которая позиционирует 4'-аминогруппу пиримидина так, чтобы абстрагироваться от протона C2-H тиазолиевого кольца при активации консервативным глутаматным остатком фермента (красный). Представлены две резонансные структуры анион / илид.
2. Тиаминдифосфат
ThDP - кофактор фермента, встречающийся во всех сферах жизни. У архей и бактерий ThDP считается одним из восьми универсальных кофакторов наряду с NAD, NADP, FAD, FMN, S-аденозилметионином (SAM), пиридоксаль-5-фосфатом (PLP, витамин B6), CoA и носителем C1. тетрагидрофолат или тетрагидрометаноптерин [3].Редким исключением являются бактерии Borrelia и Rickettsia , которые не используют ThDP в качестве кофермента для метаболизма [4].
ThDP-зависимые ферменты катализируют расщепление и образование связей C-C, C-N, C-S и C-O в широком диапазоне катаболических и анаболических реакций [5]. В качестве кофермента ThDP служит электрофильным ковалентным катализатором в декарбоксилировании 2-оксокислот (, например, пируват и 2-оксоглутарат), а также в реакциях карболигирования и лиазного типа [6, 7, 8].Активным видом ThDP обычно является форма C2-анион / илид (ThDP - ), образующаяся при диссоциации протона C2-H от тиазольного кольца (рис. 1B). ThDP – является источником каталитической силы ThDP-зависимых ферментов, поскольку он может присоединяться к ненасыщенным системам и служить стоком для мобильных электронов [9, 10]. ThDP обычно требует ионов Mg 2+ или Ca 2+ для связывания фермента в V-конформации, в которой 4'-аминогруппа пиримидинового кольца расположена так, чтобы отрывать протон C2-H от тиазольного кольца (рис. 1Б) [11, 12, 13, 14, 15].Этому отщеплению протонов часто помогает консервативный глутаматный остаток (Glu) фермента, который обеспечивает карбоксилатную боковую цепь для водородной связи с N1 'пиримидинового кольца и для протонного реле с образованием каталитического промежуточного соединения ThDP - (рис. 1B). ). Таким образом, ThDP принципиально отличается от коферментов тем, что оба кольца участвуют в катализе.
ThDP-зависимые ферменты используются в метаболизме пирувата, цикле TCA, пентозофосфатном пути и биосинтезе аминокислот с разветвленной цепью (Таблица 1).Археи обычно используют ThDP-зависимые 2-оксокислоты: ферредоксин оксидоредуктазы (OFOR), чтобы катализировать окислительное декарбоксилирование 2-оксокислот ( например, пируват, 2-оксоглутарат и 2-оксоизовалерат) в богатый энергией тиоэфир CoA [16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32] или обратная реакция для фиксации CO 2 в углероде клетки [33]. ThDP, Mg 2+ и кластер (ы) Fe-S являются внутренними кофакторами OFOR с ферредоксином в качестве акцептора электронов.OFOR (обычно 270 кДа) менее сложны, чем 2-оксокислотные дегидрогеназы (ODH) 5-6 МДа митохондрий и аэробных бактерий; ODH полагаются на NAD + в качестве акцептора электронов и состоят из компонентов E1p (ThDP-зависимая 2-оксокислотная декарбоксилаза), E2p (липоатацетилтрансфераза) и E3p (дигидролипоамиддегидрогеназа) [16]. Хотя некоторые археи экспрессируют мРНК, специфичные для всех трех гомологов ODH (E1p, E2p и E3p), активность ODH у архей еще не обнаружена [30]. Другие ThDP-зависимые ферменты архей включают неокислительную 3-сульфопируватдекарбоксилазу биосинтеза кофермента М [34, 35] и ацетогидроксикислоту биосинтеза аминокислот с разветвленной цепью (изолейцин, лейцин и валин) [36, 37].Предполагается, что транскетолазная активность архей [38] катализируется ThDP-зависимыми ферментами на основе сравнительной геномики [39].
| Археи | Бактерии | Эукария | EC | Фермент (сокращение и описание) | |
|---|---|---|---|---|---|
| + | + | + | 1.2.4.1 | PDH | Пируватдегидрогеназа (компонент E1p) |
| n.d. | + | + | 1.2.4.2 | OGDH | 2-оксоглутаратдегидрогеназа (компонент E1o) |
| + (редко) | + | + | 1.2.4.4 | BCOADH | Разветвленная цепь 2-оксокислотдегидрогеназа (компонент E1b) |
| + | + | + | 2.2.1.1 | TK | Транскетолаза (гликолевый альдегидтрансфераза) |
| nd | + (редкий) | + | 4.1.-.- | HACL | 2-гидроксифитаноил- / 2-гидроксиацил-CoA лиаза |
| + | + | н.о. | 1.2.3.3 | POX | Пируватоксидаза (фосфатозависимая) |
| + | + | н.о. | 1.2.7.1 | PFOR | Пируват: ферредоксин оксидоредуктаза |
| + | + | н.о. | 1.2.7.3 | KGOR | 2-оксоглутарат: ферредоксин оксидоредуктаза |
| + | + | n.d. | 1.2.7.7 | VOR | 2-оксоизовалерат: ферредоксин оксидоредуктаза |
| + | + | н.о. | 1.2.7.8 | IOR | Индолепируват: ферредоксин оксидоредуктаза |
| н.о. | + (редкий) | н.о. | 1.2.7.10 | - | Оксалат: ферредоксин оксидоредуктаза |
| н.о. | нет данных | + | 2.2.1.3 | DHAS | Дигидроксиацетонсинтаза (формальдегид транскетолаза) |
| + | + | + | 2.2.1.6 | AHAS | Ацетогидроксикислотсинтаза (ацетилацетатсинтаза) |
| н.о. | + | + | 2.2.1.7 | DXPS | 1-дезокси-D-ксилулоза 5-фосфатсинтаза |
| + | + | + | 2.2.1.9 | MenD | 2- Синтаза сукцинил-5-енолпирувил-6-гидрокси-3-циклогексен-1-карбоновой кислоты |
| nd | + | н.о. | 2.5.1.66 | CeaS | N2- (2-карбоксиэтил) аргининсинтаза |
| ? | + | ? | 3.7.1.11 | - | Циклогексан-1,2-дион гидролаза |
| ? | + | + | 4.1.1.1 | PDC | Пируватдекарбоксилаза |
| + | + | н.о. | 4.1.1.7 | BFD | Бензоилформиатдекарбоксилаза |
| n.d. | + | н.о. | 4.1.1.8 | OXC | Оксалил-КоА декарбоксилаза |
| ? | ? | + | 4.1.1.43 | - | Фенилпируватдекарбоксилаза |
| н.о. | + | н.о. | 4.1.1.47 | GCL | Глиоксилаткарболигаза (тартронат-полуальдегидсинтаза) |
| н.о. | + | н.о. | 4.1.1.71 | KGD | 2-оксоглутаратдекарбоксилаза |
| + | + | н.о. | 4.1.1.74 | IpdC | Индолепируватдекарбоксилаза |
| + | + | н.о. | 4.1.1.79 | ComDE | Сульфопируватдекарбоксилаза |
| + (редко) | + | + | 4.1.1.82 | PnPyDC | 3-Фосфонопируват декарбоксилаза | n.
| + | + | 4.1.2.9 | PHK | Фосфокетолаза (D-ксилулозо-5-фосфатфосфокетолаза) | |
| ? | + | ? | 4.1.2.38 | BAL | Бензальдегидлиаза (бензоинальдолаза) |
Таблица 1.
Тиаминдифосфат (ThDP) -зависимые ферменты и их распределение по трем областям жизни. Гомолог фермента обнаружен (+), не обнаружен (н.о.) или низкая гомология (?), Как указано.
3. Биосинтез тиамина de novo
Тиамин синтезируется de novo путем раздельного образования тиазольных и аминопиримидиновых колец и последующего соединения этих колец с образованием ThMP, предшественника ThDP. Пути de novo зависят от подводимой энергии (АТФ), промежуточных соединений на основе углерода и азота и источника серы (последняя включена в тиазольное кольцо).
3.1. Синтез и фосфорилирование аминопиримидинового кольца тиамина
ThiC (HMP-P-синтаза; EC 4.1.99.17) - главный фермент, используемый бактериями [40, 41], хлоропластами растений [42] и архей [43] для синтеза аминопиримидинового кольца тиамина (рисунки 2-4). ThiC превращает 5'-фосфорибозил-5-аминоимидазол (AIR) в 4-амино-5-гидроксиметил-2-метилпиримидинфосфат (HMP-P), таким образом, направляя углеродно-азотные скелеты пуринового метаболизма на биосинтез тиамина. ThiC представляет собой радикальный фермент SAM, который инициирует эту каталитическую реакцию с помощью кластера [4Fe-4S] + , который восстанавливает SAM до метионина и 5'-дезоксиаденозильного радикала [40], предполагаемого окисляющего косубстрата реакции [ 44].
Рисунок 2.
Биосинтез тиамина (витамина B1) у бактерий. Ферменты обсуждаются в тексте и окрашены в соответствии с филогенетическим распределением (красный - только в одной сфере жизни; синий - во всех сферах жизни; зеленый - очевидные гомологи во всех сферах жизни, но нет прямых доказательств). Сокращения: AIR, 5-аминоимидазол риботид; SAM, S-аденозилметионин; GAP3P, D-глицеральдегид-3-фосфат; HMP-P, 4-аминогидроксиметил-2-метилпиримидинфосфат; HMP-PP, 4-аминогидроксиметил-2-метилпиримидиндифосфат; ThMP, монофосфат тиамина; ThDP, дифосфат тиамина; DXP, 1-дезокси-D-ксилулоза 5-фосфат; cTHZ-P, 2 - [(2R, 5Z) -2-карбокси-4-метилтиазол-5 (2H) -илиден] этилфосфат; THZ-P, 4-метил-5- (β-гидроксиэтил) тиазолий фосфат; X, переносчик электронов.
Рис. 3.
Биосинтез тиамина (витамина B1) у эукариот. Синяя заливка указывает на наличие дрожжей. Сокращения: АДФ-тиазол, АДФ-5-этил-4-метилтиазол-2-карбоксилат; PLP, пиридоксальфосфат; R5P, D-рибозо-5-фосфат.?, На сегодняшний день не определено. Дополнительные сокращения и схему окраски см. На рисунке 2.
Рисунок 4.
Биосинтез тиамина (витамина B1) в архее. Аббревиатуры и схему окраски см. На рисунках 2, 3.
THI5 образует аминопиримидиновое кольцо тиамина из субстратов PLP и гистидина в дрожжах [45, 46] (рисунок 3).Только подмножество белков семейства THI5 (IPR027939) имеет консервативный остаток гистидина, необходимый для синтеза HMP-P [45], и, по-видимому, ограничен дрожжами, грибами, растениями (нехлоропластами) и некоторыми γ-протеобактериями. Бактериальные связывающие растворенные вещества белки ABC-типа для транспорта предшественника HMP (ThiY) [47] и рибофлавина (RibY) [48] структурно родственны THI5. Таким образом, предполагается, что белки семейства THI5 архей, лишенные консервативного остатка гистидина, выполняют аналогичную роль в транспорте.
Белки домена ThiD используются в качестве бифункциональных ферментов киназы HMP (EC 2.7.1.49) / HMP-P (EC 2.7.4.7) в биосинтезе и утилизации тиамина (рисунки 2-4). Бактериальный ThiD [49, 50] и дрожжевые THI20 и THI21 (белки N-концевого домена ThiD) [51] фосфорилируют HMP-P в HMP-PP в пути de novo и последовательно фосфорилируют HMP в HMP-PP в пути спасения. . У бактерий идентифицированы белки с необычным доменом ThiD2 (автономный или слитый с ThiE) как катализатор только киназной активности HMP-P, что потенциально позволяет избежать неправильного включения поврежденных и / или токсичных аналогов HMP в ThDP-зависимые ферменты [52].Гомологи ThiD (IPR004399) широко распространены во всех сферах жизни, включая организмы, которые спасают только HMP и не синтезируют тиамин de novo . Белки ThiD архей автономны или слиты с ThiN-типом ThMP-синтазным доменом (см. Обсуждение ниже) [43, 53, 54].
3.2. Синтез тиазольного кольца тиамина
De novo Биосинтез тиазольного кольца можно разделить на два принципиально различных пути в зависимости от типа тиазолсинтазы (ThiG vs.Thi4). Несмотря на сходную номенклатуру, тиазолсинтазы ThiG- и Thi4-типов различаются по структуре и функциям. ThiG-зависимый путь основан на по крайней мере шести стадиях образования THZ-P и, по-видимому, ограничен бактериями на основании филогенетического распределения ThiG (EC 2.8.1.10) (Рисунок 2). В отличие от этого, ветвь Thi4-типа для биосинтеза тиазола проще, имея только две стадии (рисунки 3-4), и кажется более распространенной, поскольку Thi4-гомологи (KEGG K03146) представлены во всех сферах жизни и, как продемонстрировано, функционируют в Биосинтез тиазольного кольца у дрожжей [55] и архей [56, 57].
3.2.1. Синтез тиазольного кольца тиамина по ThiG-пути
Для образования тиазольного кольца ThiG использует три субстрата: () дегидроглицин, (ii) 1-дезокси-D-ксилулозо-5-фосфат (DXP) и (iii) тиокарбоксилированный ThiS [58, 59, 60, 61] (рис. 2).
(i) Дегидроглицин синтезируется либо кислородзависимыми (ThiO; EC 1.4.3.19), либо радикальными ферментами SAM (ThiH; EC 4.1.99.19), оба из которых широко распространены у бактерий, но обычно отсутствуют у архей и эукариот.Глициноксидаза ThiO катализирует окислительное дезаминирование глицина с образованием дегидроглицина, необходимого для синтеза тиазольного кольца [62, 63, 64, 65]. Напротив, тирозинлиаза ThiH образует 5'-дезоксиаденозильный радикал, который инициирует расщепление связи C альфа-C бета тирозина с образованием дегидроглицина (необходимого для биосинтеза тиамина) и п-крезола (побочного продукта) [66, 67, 68].
(ii) 1-дезокси-D-ксилулозо-5-фосфатсинтаза (Dxs; EC 2.2.1.7) представляет собой ThDP-зависимый фермент, который конденсирует (гидроксиэтил) -группу, полученную из пирувата, с C1-альдегидной группой D -глицеральдегид-3-фосфат (GAP3P) с образованием DXP и CO 2 [69, 70].Гомологи Dxs (IPR005477) широко распространены у бактерий, зеленых водорослей, высших растений и простейших, но редки у архей. Dxs генерирует DXP-предшественник тиамина, пиридоксола и путей биосинтеза немевалонатных изопреноидов [69, 70]. DXP используется для биосинтеза тиамина у бактерий, но не у эукариот или архей (рис. 2).
(iii) ThiG-зависимый путь использует релейную систему на основе белка для мобилизации серы в тиазольное кольцо. Сера передается от L-цистеина к остатку цистеина активного центра серотрансферазы ( e.грамм. , IscS-SH) [71] с образованием промежуточного фермента персульфида (, например, , IscS-S-SH) [72]. В отдельной реакции E1-подобный ThiF аденилирует C-конец убиквитинового белка ThiS по механизму, напоминающему стадию активации убиквитинирования [73]. Эта стадия модификации подготавливает C-конец ThiS к тиокарбоксилированию. Сера передается от IcsS-S-SH к ThiS через домен роданезы ThiI (RHD) [71, 74, 75, 76]. Образующийся тиокарбоксилированный ThiS служит донором серы для ThiG-опосредованного синтеза тиазольного кольца [58, 59, 60, 61].
3.2.2. Синтез тиазольного кольца тиамина с помощью Thi4-пути
Thi4-путь, используемый для образования тиазольного кольца (Рисунки 3, 4), отличается от ThiG (Рисунок 2). Ключом к этому пути является Thi4-опосредованное образование ADP-тиазола, который затем гидролизуется до THZ-P предполагаемой гидролазой NUDIX [55]. Белки семейства Thi4 (IPR002922) распространены во всех сферах жизни и, как правило, отсутствуют у ThiG-содержащих бактерий. Хотя первоначально аннотированные как рибозо-1,5-бисфосфатизомеразы (R15Pi) на основании непрямого анализа [77], гомологи Thi4 архей, как было обнаружено, отличаются от архей R15Pi семейства e2b2 [78, 79] и продемонстрировали, что они катализируют активность тиазолсинтазы. [56], которая репрессируется транскрипцией, когда уровни тиамина и THZ достаточны [43], и требуется для образования тиазольного кольца [57]. In vitro дрожжевой Thi4 действует по суицидному механизму, мобилизуя серу своего цистеина в активном центре (C205) с образованием ADP-тиазола из NAD и глицина [55]. Напротив, метаноген Thi4 использует остаток гистидина в активном центре и железо для катализирования синтеза АДФ-тиазола из НАД, глицина и сульфида [56]. Ферменты Thi4 архей, дрожжей [80] и растений [81] связаны на основе рентгеновской кристаллической структуры; Кроме того, дрожжевой Thi4, модифицированный для использования остатка гистидина в активном центре, может действовать по каталитическому механизму с железом аналогично метаногену Thi4 [56, 80].
3.2.3. Конденсация аминопиримидинового и тиазольного колец с образованием ThMP
После образования предшественники тиаминового кольца (, т.е. THZ-P и HMP-PP) конденсируются до ThMP с помощью ThMP-синтазы ThiE- или ThiN-типа (EC 2.5.1.3).
ThiE-типа ThMP-синтазы широко распространены во всех сферах жизни (IPR036206) и, как обнаружено, катализируют замену дифосфата HMP-PP на THZ-P с образованием ThMP, CO 2 и дифосфата (PPi) у бактерий. [82, 83], растения [84] и дрожжи [85].Гомологи ThiE часто являются бифункциональными, слитыми с дополнительным каталитическим доменом, таким как киназа HMP-P (EC 2.7.4.7) [52, 84, 85]. ThiE служит в качестве ThMP-синтазы у некоторых архей, поскольку он необходим для роста галоархей в отсутствие тиамина, HMP и / или THZ [43].
ThMP-синтазы ThiN-типа также идентифицированы у архей и бактерий, но отсутствуют у эукариот. Белки с ThiN-доменом (IPR019293) бывают трех основных типов: I) слитые с N-концевым ДНК-связывающим доменом (тип ThiR), II) слитые с N- или C-концевым каталитическим доменом ( e.g., ThiD) и III) автономные домены ThiN. Белки ThiDN представляют собой ThMP-синтазы на основе анализа in vitro и комплементации мутантов ΔthiE для роста в отсутствие тиамина [43, 53, 54]. Предполагается, что слияние ThiN-домена с киназным доменом HMP / HMP-P (ThiD) минимизирует высвобождение HMP-PP до его конденсации с THZ-P и, таким образом, направляет субстрат к продукту ThMP [43]. Домены ThiN, у которых отсутствует консервативная α-спираль рядом с активным сайтом гистидина, не являются ThMP-синтазами и вместо этого могут служить очевидными сайтами связывания лиганда для регуляции транскрипции, как в ThiR (см. Обсуждение ниже) [43].
3.2.4. Образование ThDP из ThMP или тиамина
Тиаминдифосфат (ThDP), биологически активная форма тиамина, продуцируется из ThMP двумя путями. ThMP обычно фосфорилируется до ThDP с помощью АТФ-зависимой ThiL ThMP-киназы (EC 2.7.4.16 из IPR006283) у бактерий [86] и архей [87]. Альтернативно, ThMP гидролизуется до тиамина, а тиамин превращается в ThDP под действием Mg 2+ -зависимой тиаминпирофосфокиназы TPK (THI80), которая катализирует тиамин + ATP ⇆ ThDP + AMP (EC 2.7.6.2) у эукариот [88, 89, 90, 91]. В соответствии с этим последним путем, TPK необходим для de novo биосинтеза тиамина в дрожжах [89, 90], а ThMP фосфатаза Th3 может гидролизовать ThMP до тиамина в растениях [92]. TPK также используется для передачи тиамина в ThDP у эукариот [91, 93] и некоторых бактерий (гомолог TPK YloS) [93]; напротив, γ-протеобактерии используют тиаминкиназу (ThiK, EC 2.7.1.89) для фосфорилирования тиамина до ThMP [93] до ThiL-опосредованного фосфорилирования ThMP до ThDP.В то время как гомологи TPK (IPR036759) консервативны у некоторых архей, ThiK - нет. В связи с этим вызывает недоумение то, что некоторые археи (, например, haloarchaea и Pyrobaculum ) имеют транспорт тиамина ThiBQP и гомологи ThiL ThMP киназы, но не имеют гомологов или активности ThiK или TPK ( например, Pyrobaculum californica ) [87]. Более того, археи, лишенные гомологов TPK и ThiK, могут транспортировать тиамин и генерировать ThDP, что продемонстрировано ростом мутанта ThMP-синтазы, Haloferax volcanii ΔthiE , при добавлении тиамина, но не THZ или HMP [43, 57].Эти данные позволяют предположить, что некоторые археи используют альтернативный путь для передачи тиамина в ThDP.
4. Транспорт тиамина
Тиамин - это микроэлемент, который активно транспортируется в клетки против градиента концентрации. Транспорт тиамина и его предшественников устраняет потребность в биосинтезе тиамина de novo . Транспортеры тиамина предсказываются у архей на основе гомологии с бактериальными транспортными системами или идентификации предполагаемых генов-транспортеров, которые находятся либо в геномной синтении с генами биосинтеза тиамина, либо ниже по течению от мотивов рибопереключателя, связывающего ThDP (THI-бокс) [57, 94, 95, 96 ].
Бактериальные переносчики тиамина и предшественников тиамина, консервативные в архее, можно разделить на: (i) переносчики типа ABC (, например, ., ThiBPQ и ThiYXZ) [47, 97, 98], (ii) новый ABC -типа, называемого импортерами фактора энергетической связи (ECF) [95, 99], (iii) транспортеры NiaP [100] суперсемейства основных фасилитаторов (MSF, IPR036259), которые используют ионный градиент [101], и (iv) транспортеры PnuT, которые опосредуют облегченную диффузию тиамина [102, 103]. ABC и ECF являются первичными активными переносчиками, которые гидролизуют АТФ при захвате тиамина с помощью консервативных АТФаз (рис. 5).Транспортеры ECF и ABC различаются по типу белка, используемого для связывания растворенного вещества: ECF использует белок трансмембранного захвата субстрата (S-компонент, ThiT), в то время как ABC использует экстрацитоплазматический белок, связывающий растворенное вещество (, например, ThiB или ThiY) [95, 99]. Системы ECF обычно являются модульными в том смысле, что ThiT и другие S-компоненты ( например, биотин-специфический BioY) взаимозаменяемо связываются с трансмембранным (T) компонентом системы [95, 99, 104]. Для сравнения, системы ABC не являются модульными и содержат белки, связывающие растворенные вещества (ThiB / Y), которые связываются с внецитоплазматическим доменом переносчика [47, 48, 105, 106].
Рис. 5.
Сравнение транспорта тиамина импортерами ABC и ECF. Нуклеотид-связывающие домены, которые гидролизуют АТФ и управляют транспортером, показаны синим цветом. Белок трансмембранного домена ABC-типа (ThiP) и T-компонент ECF-типа (EcfT) имеют оттенки зеленого. Растворимый связывающий белок (ThiB, ThiY) импортера ABC выделен темно-оранжевым цветом. S-компоненты тиамина (ThiT) и биотина (BioY), импортируемые ECF, которые можно менять местами, имеют оттенки оранжевого.
5. Спасение тиамина
Спасение тиамина и его производных извне и внутри клетки для пополнения и восстановления кофактора ThDP для метаболизма.Пути восстановления тиамина широко распространены во всех сферах жизни и преодолевают потребность в биосинтезе de novo тиамина, минимизируют затраты энергии и уменьшают неправильное включение продуктов распада тиамина в активные центры ThDP-зависимых ферментов [107].
Было обнаружено, что археи спасают тиамин и его производные (HMP и THZ) из окружающей среды [43, 57] и подавляют биосинтез тиамина de novo , когда уровень тиамина достаточен [43, 108]. Предполагается, что пути спасения архей включают ферменты биосинтеза de novo ( i.е., ThiD, ThiE или ThiDN и ThiL) с ферментами, специфичными для спасения, такими как ThiM (THZ-киназа, EC 2.7.1.50), TenA (аминопиримидинаминогидролаза, EC 3.5.99.2) и / или YlmB (формиламинопиримидиндеформилаза, EC 3.5.1.-) последнее предположение, поскольку оно объединяется в семейство белков (IPR010182), которое включает сукцинилдиаминопимелатдесукцинилазу и YodQ синтеза N-ацетил-бета-лизина [57] (Рисунок 6). ThiM представляет собой THZ-киназу у бактерий [49, 109, 110, 111], протистов [112] и растений [113] и предсказывается для архей ( e.g., UniProtKB D4GV40) на основе консервативных остатков активного сайта [114]. Гомологи TenA подразделяются на TenA_C и TenA_E [115] на основе консервативных остатков цистеина и глутамата в активном центре соответственно. Оба типа белков TenA консервативны в архее. Показано, что TenA_C является аминогидролазой, которая работает совместно с деформилазой YlmB для регенерации HMP из продуктов распада тиамина и действует как тиаминаза II, которая гидролизует тиамин до THZ и HMP в бактериях [94, 116].Обратите внимание, что тиаминаза I (EC 2.5.1.2), которая секретируется некоторыми бактериями для разложения тиамина [117, 118], отличается от TenA. У растений TenA_E является бифункциональным в катализе активности деформилазы и аминогидролазы для регенерации HMP из продуктов распада тиамина, таким образом преодолевая потребность в YlmB [115]. TenA_C и TenA_E законсервированы у архей и, вероятно, будут действовать в восстановлении тиамина.
Рис. 6.
Спасение тиамина (витамина B1) в архее. Сокращения: Формиламино-HMP, N-формил-4-амино-5-аминометил-2-метилпиримидин; амино-HMP, 4 амино-5-аминометил-2-метилпиримидин; HMP, 4-амино-5-гидроксиметил-2-метилпиримидин; THZ, 4-метил-5- (2-гидроксиэтил) тиазол.Дополнительные сокращения и схему окраски см. На рисунках 2-4.
6. Регулирование тиамина
Биосинтез тиамина, пути его восстановления и / или транспорта регулируются рибопереключателями THI-бокса у бактерий [119, 120, 121], эукариот [122, 123, 124, 125] и некоторых архей ( на основе Rfam RF00059) [43, 96]. Рибопереключатель THI-box является регуляторным элементом мРНК / пре-мРНК аптамера, который связывает метаболит тиамина, и платформу экспрессии, которая трансдуцирует связывание лиганда для контроля экспрессии гена [126].У бактерий, когда уровни ThDP достаточны, ThDP связывает 5'-нетранслируемую область (UTR) THI-бокса и запускает образование структуры петля-стебель, которая маскирует последовательность Шайна-Дальгарно (SD) мРНК и ингибирует трансляцию. инициация [119, 120, 121]. Основными мишенями этой регуляции являются мРНК метаболических оперонов тиамина (, например, thiCEFSGH и thiMD в E. coli ) [119, 120, 121] и транспортер тиамина ABC-типа ( thiBPQ ) , причем последний основан на анализе мотивов (Rfam RF00059).Эукариоты (растения, грибы и водоросли) также используют рибопереключатель THI-бокса для регулирования экспрессии метаболизма тиамина, но делают это путем модуляции альтернативного сплайсинга пре-мРНК [42, 122, 123, 124, 125, 127, 128, 129 , 130]. В этих эукариотических системах ThDP или HMP-PP связывает рибопереключатель THI-бокса интрона, расположенного в 5'- или 3'-UTR, и вызывает неправильное спаривание донора сплайсинга (GU) и акцептора (AG) пре-мРНК. ( например, THIC и THI4 ). Это неправильное спаривание способствует альтернативному разрезанию мРНК и, таким образом, снижает биосинтез тиамина.
Метаболизм тиамина также регулируется факторами транскрипции, примером чего являются организмы, которые синтезируют тиамин de novo , но не имеют мотива рибопереключателя THI-бокса, включая дрожжи и многие археи. У дрожжей три белка (Thi2p, Thi3p и Pdc2p) координируют индукцию экспрессии гена биосинтеза тиамина ( THI ) в ответ на тиаминовое голодание [131, 132, 133, 134, 135, 136]. Thi3p служит сенсором тиамина для двух факторов транскрипции (Thi2p и Pdc2p), которые связывают специфические последовательности ДНК перед генами THI .При низком уровне тиамина Thi3p образует тройной комплекс с Thi2p и Pdc2p, который активирует транскрипцию генов THI . Когда уровень тиамина становится достаточным, Thi3p связывает ThDP, вызывая диссоциацию Thi3p из тройного комплекса и снижая экспрессию генов THI . У архей из филы Euryarchaeota [43] и Crenarchaeota [108] обнаружено, что новый фактор транскрипции, ThiR, подавляет экспрессию метаболического гена тиамина ( thi4 и thiC ), когда уровни тиамина достаточны. .ThiR состоит из N-концевого домена связывания ДНК и C-концевого домена ThiN. Домен ThiN в ThiR не является каталитическим, так как в нем отсутствует расширение α-спирали и консервативный Met рядом с His активного сайта, которые необходимы для тиазолсинтазной активности белков ThiDN [43]. Вместо этого ThiN-домен ThiR служит очевидным сенсором метаболитов тиамина, который запускает ThiR-опосредованную репрессию транскрипции thi4 и thiC в условиях достаточного количества тиамина.Этот тип регуляции транскрипции кажется обычным для архей на основании широко распространенного филогенетического распределения гомологов ThiR по сравнению с мотивами THI-бокса.
7. Перспективы на будущее и выводы
Тиамин - важный витамин для улучшения здоровья человека [137], стратегическая пищевая добавка [138, 139], нацелена на производство пробиотиков [140], полезен при открытии лекарств, в том числе разработка антиметаболитов для лечения рака или грибковых инфекций [141, 142, 143, 144], имеет потенциал для использования в качестве антитоксического агента в пищевой промышленности [145], может улучшить устойчивость растений [146], является отправной точкой для разработки новых рибопереключателей [147], участвует в центральном метаболизме и необычных биокаталитических реакциях [6, 7, 8, 148, 149, 150, 151], может модулировать глобальные циклы питательных веществ [152] и перспективен для других приложений.
Открытие метаболического пути для биосинтеза тиамина de novo в архее открывает новое окно для использования экстремофилов в биотехнологических приложениях, связанных с тиамином. Археи обозначены FDA как GRAS (обычно признанные безопасными), поддаются генетическим манипуляциям [153] и могут легко экспрессировать ThDP-зависимые ферменты из чужеродных систем ( например, бактериальная пируват декарбоксилаза) [154]. Таким образом, археи представляют собой полезный ресурс для обнаружения и оптимизации ThDP-зависимых биокатализаторов для производства возобновляемых видов топлива и химикатов.
Археи также позволяют взглянуть на происхождение путей биосинтеза тиамина с эволюционной точки зрения. Ветвь биосинтеза аминопиримидина, состоящая из радикального SAM-фермента ThiC и HMP / HMP-P киназы ThiD, кажется древней на основании ее функциональной консервативности во всех трех сферах жизни. Напротив, биосинтез тиазола можно разделить на два основных пути: ThiG- и Thi4-зависимый. Предполагается, что из этих двух подразделений Thi4-тип является довольно древним, поскольку Thi4 зависит от Fe для каталитической активности, может использовать сульфид в качестве источника серы для образования тиазольного кольца, функционально консервативен у архей и эукариот и, как предполагается, будет функционировать. у некоторых бактерий (включая анаэробы) на основе секвенирования генома.
Идентификация генов, необходимых для транспортировки, синтеза и утилизации тиамина (из трех сфер жизни), улучшает понимание того, как витамин B1 может попадать в окружающую среду. Обнаружение того, что Thi4 важен для образования тиазольных колец у эукариот и архей, открывает новые перспективы для определения организмов, которые синтезируют тиамин de novo . Предполагается, что микробы, продуцирующие тиамин и предшественники тиамина, приносят пользу другим таксонам микробов, которые не могут производить тиамин, но нуждаются в этом витамине в качестве кофактора для своей метаболической активности [152].Таким образом, межвидовой перенос витаминов может влиять на метаболизм микробных консорциумов и глобальные / углеродные энергетические циклы.
Наконец, тиамин повреждается в экстремальных условиях, таких как окисление. У растений и дрожжей есть гидролаза (Tnr3, YJR142W), которая превращает окси- и оксо-поврежденные формы ThDP в монофосфаты, чтобы избежать неправильного включения поврежденных молекул тиамина в ThDP-зависимые ферменты [155]. Многие археи процветают в условиях экстремального термического и окислительного стресса, что свидетельствует о том, что эти микробы используют уникальные механизмы для предотвращения и / или восстановления поврежденного ThDP для использования в качестве кофактора.
Выражение признательности
Средства для этого проекта были предоставлены JM-F через двустороннюю программу NSF / BIO-BBSRC (NSF 1642283), Министерство энергетики США, Управление фундаментальных энергетических наук, Отделение химических наук, наук о Земле и биологических наук, Программа физических биологических наук (DOE DE-FG02-05ER15650) и Национальные институты здравоохранения (NIH R01 GM57498).
Конфликт интересов
Автор не заявляет о конфликте интересов.
.