Какие продукты образуются при внутримолекулярной дегидратации
Внутримолекулярная дегидратация спиртов
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл =1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s 2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t° пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий неметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
дегидратация спиртов
Концентрированная серная кислота является катализатором. Напишите его над стрелкой, а не в уравнении.
Дегидратация циклогексанола с образованием циклогексена
Это препарат, обычно используемый на этом уровне для иллюстрации образования и очистки жидкого продукта. Тот факт, что атомы углерода соединены в кольцо, не имеет никакого значения для химии реакции.
Циклогексанол нагревают с концентрированной фосфорной (V) кислотой, жидкий циклогексен отгоняется, и его можно собрать и очистить.
Фосфорная (V) кислота, как правило, используется вместо серной кислоты, потому что она более безопасна и вызывает менее грязную реакцию. Фосфорная (V) кислота не является сильным окислителем.
Дегидратация более сложных спиртов
Будьте осторожны с более сложными спиртами, если существует вероятность образования более чем одного алкена.Бутан-2-ол является хорошим примером этого, поскольку при его дегидратации образуются не менее трех различных алкенов.
Бутан-2-ол - это просто пример, иллюстрирующий проблемы. Важно, чтобы вы это поняли, чтобы понять, что произойдет в подобных случаях. Было бы совершенно невозможно узнать, что происходит с каждым алкоголем, который вам может подарить.
Когда вы дегидратируете спирт, вы удаляете группу -ОН и атом водорода у следующего атома углерода в цепи.Когда это происходит с такими молекулами, как бутан-2-ол, есть две возможности.
Это приводит к этим продуктам:
Продукты представляют собой бут-1-ен, CH 2 = CHCH 2 CH 3 , и бут-2-ен, CH 3 CH = CHCH 3 .
На самом деле ситуация даже сложнее, чем кажется, потому что бут-2-ен проявляет геометрическую изомерию. Получается смесь двух изомеров - цис, -бут-2-ен и транс, -бут-2-ен.
Цис -бут-2-ен также известен как (Z) -бут-2-ен; транс -бут-2-ен также известен как (E) -бут-2-ен. Чтобы узнать о двух способах наименования этих двух соединений, перейдите по ссылке в поле ниже.
Какой изомер образуется - дело случая.
.Внутримолекулярный синтез эфира Вильямсона - магистр органической химии
Внутримолекулярный синтез эфира Вильямсона. «Внутримолекулярные реакции заставляют меня скомкаться до положения плода, я плачу по маме»
Вот тема, которая не совсем соответствует тому, что мы обсуждали ранее, но она важна для любого обсуждения спиртов и эфиров. Внутримолекулярные реакции.
Вот краткое содержание:

Содержание
- Внутримолекулярные версии реакций решают большие проблемы исследования Кольцо к цепи
- Как нарисовать внутримолекулярный продукт реакции за 5 простых шагов
- Резюме: Внутримолекулярные реакции спиртов и эфиров
- Примечания
1.Совет: внутримолекулярные реакции создают большие проблемы для экзаменов
Внутримолекулярные реакции [т.е. реакции, в которых две функциональные группы в молекуле взаимодействуют друг с другом] вызывают удивительное недоумение со стороны студентов.
Посмотрите, что читатель Томас недавно сказал по этой теме:
« Я ненавижу внутримолекулярные реакции , особенно когда речь идет о ретросинтетическом анализе. Дайте мне связку колец, склеенных вместе, и я сжимаюсь в позе эмбриона, плача по мамочке.Не знаю, как с ними бороться. Обычно не имеет представления о том, какие сайты ссылаются на прекурсоры или как систематически подходить к проблемам. ИМХО, в органических классах этому почти не учат. В большинстве книг, кажется, почти не упоминаются внутримолекулярные реакции, не говоря уже о том, чтобы их исследовать как проблемную область для студентов. А когда этому учат, учат не очень хорошо. Часто кажется, что он просто появляется на тестах с целью уничтожить учеников. Отсутствие внимания к этой теме кажется мне крайне странным, учитывая, насколько это невероятно важно для химического синтеза и биохимии.
Томас попадает в самую точку: Этих реакций очень много на экзаменах. Считайте инструкторов чем-то вроде бейсбольных питчеров. Когда дело доходит до экзаменов, они не всегда продвигают мячики по центру тарелки. Иногда они прибегают к кривым и изменениям. А внутримолекулярные версии реакций, которые вы уже изучили, - идеальные вопросы для экзамена, потому что они не связаны с новыми концепциями - они являются просто продолжением той же реакции.
Давай копнем.
2. Внутримолекулярный синтез эфира Вильямсона
Прежде всего, давайте начнем с изучения известной территории: синтеза эфира Вильямсона. Я знаю, что я нарисовал здесь немного странно, но это сделано с определенной целью.
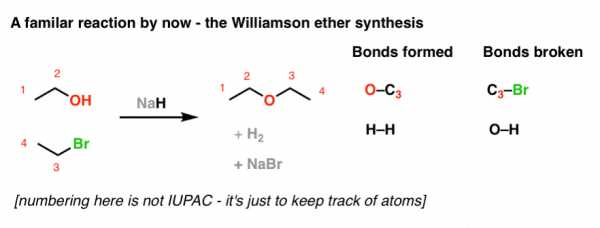
Это довольно просто, правда? Мы ломаем C-Br и формируем C-O. Назначение NaH [сильного основания] - депротонировать спирт (образуя в процессе H 2 ), превращая его в нуклеофильный алкоксид-ион, который затем выполняет реакцию замещения [механизм S N 2].Помните - конъюгированное основание всегда лучше нуклеофила.
Теперь давайте изменим одну мелочь. Что происходит, когда мы соединяем C-1 и C-4 вместе (кстати, не нумерацию IUPAC - эти числа просто заполнители).
Внезапно в глазах многих студентов этот вопрос стал намного сложнее.
Держись! Не нужно «входить в позу эмбриона и плакать по мамочке» - это, по сути, тот же вопрос !! НЕТ РАЗНИЦЫ в образующихся и разрывающихся узах.Нуль!
Единственное отличие состоит в том, что нуклеофил и электрофил присоединены друг к другу в цепочку .
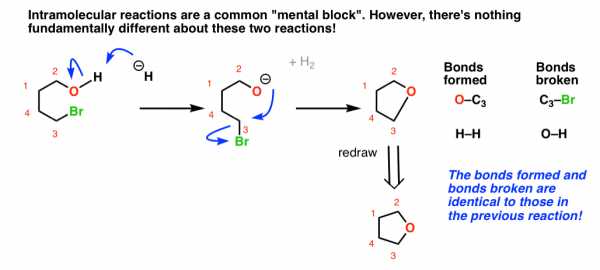
3. Все, что мне когда-либо нужно было знать о внутримолекулярных реакциях, я узнал, надев ремень
Если эта реакция показалась вам странной, возможно, вы просто еще не видели подобных примеров. Какое-то время назад я написал на эту тему сообщение, в котором я сравнил внутримолекулярные реакции с надеванием пояса. Видите, у ремня есть нуклеофил [булавка] и электрофил [выемка], и они прикреплены друг к другу по длине кожи (или в данном случае кожзаменителя). Поскольку у вас, несомненно, есть опыт работы с ремнями, вам интуитивно понятно, что здесь произойдет - мы формируем петлю!

Ключевой урок здесь заключается в том, что молекулы могут действовать так же, как ленты . Они могут переходить от цепей к кольцам и обратно к цепям.
4. Обратный ход: переход от кольца к цепочке
А как насчет противоположного случая - перехода от кольца к цепочке? Та же концепция.Следуйте за образующимися узами и разрывающимися узами!
Сначала давайте разберемся с диэтиловым эфиром. Как мы видели, для этого можно использовать сильную кислоту, например йодистоводородную кислоту (HI).
Теперь возьмем тетрагидрофуран, циклический эфир. А теперь давайте добавим к нему крепкую кислоту. Что происходит?
Не паникуйте! Это та же последовательность связей, которые образуются и разрываются, как и раньше.
Сначала мы протонируем кислород, чтобы получить конъюгированную кислоту, которая теперь является более удаляемой группой.Во-вторых, иодид-ион затем атакует углерод, образуя C – I и разрушая O – C [в данном случае SN2].
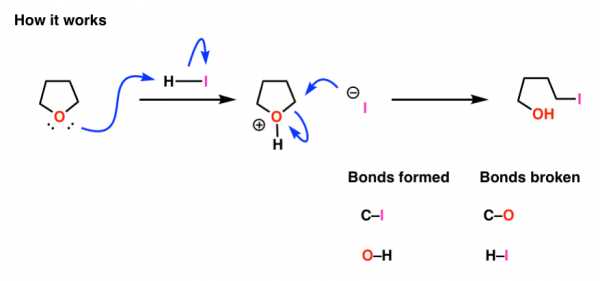
Итак, первая часть сегодняшнего урока такова: связи, которые образуются и разрываются во внутримолекулярных процессах (образование или разрушение колец), принципиально не отличаются от тех, которые образуются и разрываются в межмолекулярных процессах.
5. Как нарисовать продукты внутримолекулярных реакций за 5 простых шагов
Есть еще одна важная причина, по которой учащиеся находят внутримолекулярные реакции трудными.Рисовать продукты может быть непросто. Это частый источник потерянных очков.
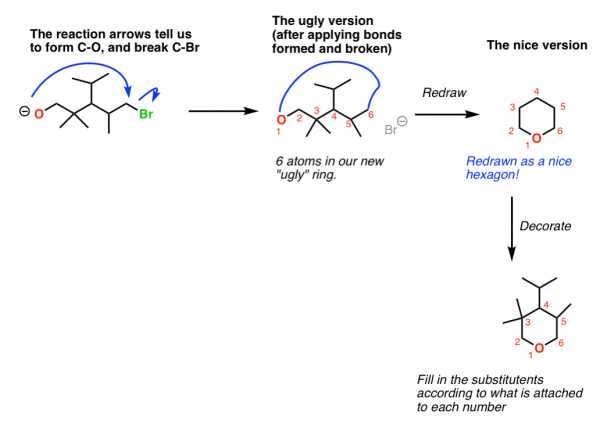
Вот трюк, который помогает в этих проблемах. Сначала нарисуйте уродливую версию.
Диаграмма ниже показывает, что я имею в виду. Вот последовательность шагов.
1. Определите стрелки реакции (какие связи образуются и разрываются) для вашей реакции.
2. Перерисуйте исходный материал. Пронумеруйте атомы в цепочке (не ИЮПАК, просто для отслеживания вещей).
3. Разорвите все связи, обозначенные стрелками реакции.Затем для образующихся связей просто соединяет эти два атома в пространстве . Да, это будет некрасиво смотреться. Все в порядке. Мы сделаем это позже.
4. Подсчитайте количество атомов, образующих ваше новое кольцо. Нарисуйте соответствующий «красивый» многоугольник.
5. При необходимости украсьте новый «красивый» многоугольник, используя цифры в качестве ориентира.
Ключевым моментом является определение размера вашего нового кольца. Поэтому внимательно посчитайте количество атомов . В приведенном ниже примере мы формируем 6-членное кольцо.В «уродливом варианте» наше 6-членное кольцо выглядит дерьмом. Но зная, что шестичленное кольцо - это красивый шестиугольник, следующий шаг - просто «перевести» дрянной рисунок в шестиугольник. Цифры помогают нам определить, где «украсить» наш новый многоугольник.
6. Резюме: Внутримолекулярные реакции спиртов и эфиров
Этого, вероятно, достаточно для наших целей. Так что, если вы хотите двигаться дальше, обязательно сделайте это. Тем не менее, есть последний вопрос, на котором стоит остановиться хотя бы вкратце, и я отправил его в конец этого поста.
Следующее сообщение: Защитные группы для спиртов
Примечания
Бонусный раздел: Заключительное примечание о скорости образования кольца
Я должен закончить предостережением о реакциях, которые приводят к образованию кольца. Один из часто возникающих вопросов: «, когда я узнаю, когда новое кольцо сформирует ?» [Ярлык-спойлер: да для 5 и 6 (и 3), обычно «нет» для колец 7 и выше]
Отличный вопрос! Это одна из тех проблем, которые делают органическую химию «сложной» для новичка, но «глубокой» и «интересной» для практикующего на протяжении всей жизни, потому что есть несколько ключевых факторов, которые часто работают в противоположных направлениях.
Во-первых: не все кольца формируются с одинаковой скоростью. То есть скорость образования кольца в некоторой степени зависит от длины цепи.
Как это согласуется с тем, что мы уже знаем о реакциях замещения. Помните, что скорость реакции замещения пропорциональна концентрации нуклеофила и концентрации электрофила. Но что происходит, когда нуклеофил и электрофил находятся в одной молекуле? Для этого мы используем концепцию, называемую «эффективная концентрация», которая означает, что скорость реакции будет связана с тем, сколько времени нуклеофил проводит рядом с электрофилом.В этом посте нет места, чтобы вдаваться в подробности, но давайте воспользуемся ремнями на липучке на этой обуви в качестве чрезмерно упрощенного примера.

Если застежки-липучки на слишком короткие , то нуклеофил (ремешок) не может дотянуться до электрофила (на обуви). Если застежки-липучки на длиннее (представьте, если бы каждая из них была длиной в фут, например!), То надевать обувь будет неудобно из-за уменьшения вероятности того, что нуклеофил будет находиться рядом с электрофилом ( пример низкой «эффективной концентрации»).Скорость образования очень больших колец будет приближаться к скорости межмолекулярных реакций.
Конечно, молекулы сложнее ремней (или лент на липучках) из-за идеальных углов тетраэдрических атомов углерода 109 °. Это создает дополнительную сложность, особенно проблему деформации кольца .
Например, к этому моменту вы, вероятно, знаете, что 3- и 4-членные кольца достаточно напряжены, тогда как кольца размера 5, 6 и 7 относительно не напряжены. Если вы только начинаете, вы, вероятно, не подозреваете, что кольца размера 8-11 натянуты по очень интересной причине (трансаннулярная деформация - сейчас не будем обсуждать это), а кольца размера 12 и выше обычно не деформированы.
Для студента вводного курса хорошее практическое правило: Формирование 5- и 6-членных колец происходит быстро. Кольца размера 7 и выше образуются медленно. Что касается колец меньшего размера, мы видели примеры образования 3-членных колец (из галогидринов). Менее часто, но также быстро наблюдается образование 4-членных колец.
Это расплывчатое обобщение. «Дайте мне числа!» вы могли бы сказать. В моем экземпляре марта говорится следующее. Обратите внимание, что это для другой реакции, чем синтез эфира Вильямсона [образование циклических сложных эфиров через SN2 карбоксилатов с алкилгалогенидами], но тенденция должна сохраниться.
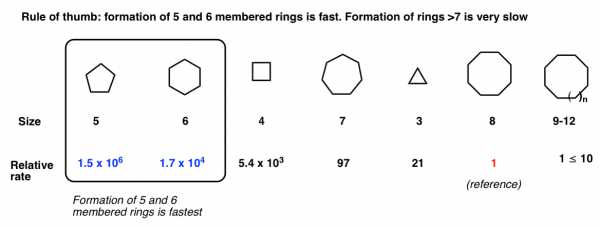
Для более количественного подхода я предлагаю вам изучить эту статью о кинетике замыкания кольца.
.
Обезвоживание - Симптомы и причины
Обзор
Обезвоживание происходит, когда вы употребляете или теряете больше жидкости, чем принимаете, и вашему организму не хватает воды и других жидкостей для выполнения своих обычных функций. Если вы не восполните потерю жидкости, вы получите обезвоживание.
Любой может получить обезвоживание, но это состояние особенно опасно для маленьких детей и пожилых людей.
Самая частая причина обезвоживания у детей раннего возраста - сильная диарея и рвота.У пожилых людей естественный объем воды в организме меньше, и они могут иметь заболевания или принимать лекарства, которые увеличивают риск обезвоживания.
Это означает, что даже незначительные заболевания, такие как инфекции, поражающие легкие или мочевой пузырь, могут привести к обезвоживанию у пожилых людей.
Обезвоживание также может произойти в любой возрастной группе, если вы не пьете достаточно воды в жаркую погоду - особенно если вы много занимаетесь спортом.
Обычно вы можете обратить вспять легкое или умеренное обезвоживание, выпив больше жидкости, но тяжелое обезвоживание требует немедленной медицинской помощи.
Симптомы
Жажда не всегда является надежным ранним индикатором потребности организма в воде. Многие люди, особенно пожилые, не чувствуют жажды, пока не обезвожены. Вот почему так важно увеличивать потребление воды в жаркую погоду или когда вы больны.
Признаки и симптомы обезвоживания также могут различаться в зависимости от возраста.
Младенцы или дети раннего возраста
- Сухость во рту и языке
- Нет слез при плаче
- Три часа без влажных подгузников
- Глаза впалые, щеки
- Впавшее мягкое пятно на верхней части черепа
- Вялость или раздражительность
Взрослый
- Сильная жажда
- Менее частое мочеиспускание
- Моча темного цвета
- Усталость
- Головокружение
- Путаница
Когда обращаться к врачу
Позвоните своему семейному врачу, если вы или любимый человек:
- Диарея в течение 24 часов и более
- Раздражительный или дезориентированный, гораздо более сонный или менее активный, чем обычно
- Жидкости не удерживаются
- Стул окровавленный или черный
Причины
Иногда обезвоживание происходит по простым причинам: вы недостаточно пьете, потому что больны или заняты, или из-за отсутствия доступа к безопасной питьевой воде во время путешествий, походов или кемпинга.
Другие причины обезвоживания включают:
- Диарея, рвота. Тяжелая острая диарея, то есть диарея, которая возникает внезапно и резко, может вызвать огромную потерю воды и электролитов за короткое время. Если у вас рвота и диарея, вы теряете еще больше жидкости и минералов.
- Лихорадка. Как правило, чем выше температура, тем сильнее обезвоживание. Проблема усугубляется, если в дополнение к диарее и рвоте у вас повышается температура.
- Чрезмерное потоотделение. Вы теряете воду, когда потеете. Если вы занимаетесь большой физической активностью и не восполняете жидкости в процессе, вы можете обезвоживаться. Жаркая и влажная погода увеличивает количество потоотделения и количество теряемой жидкости.
- Учащенное мочеиспускание. Это может быть связано с невыявленным или неконтролируемым диабетом. Некоторые лекарства, такие как диуретики и некоторые лекарства от артериального давления, также могут привести к обезвоживанию, как правило, потому, что они вызывают учащение мочеиспускания.
Факторы риска
Любой может получить обезвоживание, но некоторые люди подвержены большему риску:
- Младенцы и дети. Младенцы и дети, наиболее подверженные сильной диарее и рвоте, особенно уязвимы к обезвоживанию. Имея большую площадь поверхности к площади, они также теряют большую долю жидкости из-за высокой температуры или ожогов. Маленькие дети часто не могут сказать вам, что хотят пить, и не могут сами себе напиться.
- Пожилые люди. С возрастом запас жидкости в вашем организме становится меньше, способность сохранять воду снижается, а чувство жажды становится менее острым. Эти проблемы усугубляются хроническими заболеваниями, такими как диабет и деменция, а также приемом определенных лекарств. Пожилые люди также могут иметь проблемы с подвижностью, которые ограничивают их способность добывать воду для себя.
- Люди с хроническими заболеваниями. Неконтролируемый или нелеченый диабет подвергает вас высокому риску обезвоживания.Заболевание почек также увеличивает ваш риск, как и лекарства, увеличивающие мочеиспускание. Даже простуда или боль в горле делают вас более восприимчивыми к обезвоживанию, потому что у вас меньше шансов поесть или выпить, когда вы больны.
- Люди, которые работают или занимаются спортом на улице. В жаркую и влажную погоду увеличивается риск обезвоживания и теплового заболевания. Это потому, что когда воздух влажный, пот не может испаряться и охладить вас так быстро, как обычно, а это может привести к повышению температуры тела и потребности в большем количестве жидкости.
Осложнения
Обезвоживание может привести к серьезным осложнениям, в том числе:
- Тепловая травма. Если вы не пьете достаточно жидкости, когда вы интенсивно тренируетесь и сильно потеете, вы можете получить тепловую травму, степень тяжести варьируется от легких тепловых судорог до теплового истощения или потенциально опасного для жизни теплового удара.
- Проблемы с мочеиспусканием и почками. Продолжительные или повторяющиеся приступы обезвоживания могут вызвать инфекции мочевыводящих путей, камни в почках и даже почечную недостаточность.
- Изъятия. Электролиты, такие как калий и натрий, помогают передавать электрические сигналы от клетки к клетке. Если ваши электролиты не сбалансированы, нормальные электрические сообщения могут смешаться, что может привести к непроизвольным сокращениям мышц, а иногда и к потере сознания.
- Шок низкого объема крови (гиповолемический шок). Это одно из самых серьезных, а иногда и опасных для жизни осложнений обезвоживания. Это происходит, когда низкий объем крови вызывает падение артериального давления и уменьшение количества кислорода в вашем теле.
Профилактика
Чтобы предотвратить обезвоживание, пейте много жидкости и ешьте продукты с высоким содержанием воды, такие как фрукты и овощи. Позволить жажде быть вашим проводником - это ежедневное руководство для большинства здоровых людей.
Людям может потребоваться принять больше жидкости, если они находятся в таких условиях, как:
- Рвота или диарея. Если у вашего ребенка рвота или диарея, начните давать дополнительную воду или раствор для пероральной регидратации при первых признаках болезни.Не ждите, пока произойдет обезвоживание.
- Энергичные упражнения. В целом, лучше всего начинать пить за день до физических упражнений. Производство большого количества прозрачной разбавленной мочи - хороший показатель того, что вы хорошо гидратированы. Во время занятия регулярно пополняйте запас жидкости и продолжайте пить воду или другие жидкости после того, как закончите.
- Жаркая или холодная погода. Вам необходимо пить больше воды в жаркую или влажную погоду, чтобы снизить температуру тела и восполнить потери, связанные с потоотделением.Вам также может потребоваться дополнительная вода в холодную погоду для борьбы с потерей влаги из-за сухого воздуха, особенно на больших высотах.
- Болезнь. Пожилые люди чаще всего обезвоживаются во время незначительных заболеваний, таких как грипп, бронхит или инфекции мочевого пузыря. Не забывайте пить больше жидкости, когда чувствуете себя плохо.
19 сентября 2019 г.
.Головные боли обезвоживания: признаки, лечение и профилактика
Головные боли - одна из наиболее частых причин боли и пропущенных рабочих дней. Но каковы основные признаки того, что головная боль может быть вызвана обезвоживанием?
Есть много разных видов головных болей, и 9 из 10 взрослых испытают один в какой-то момент своей жизни.
Некоторые виды головных болей, например, обезвоживание, легко поддаются лечению и их можно избежать. В этой статье рассказывается, что такое головная боль от обезвоживания, какие признаки указывают на ее наличие и как можно ее лечить или предотвратить.
Головная боль при обезвоживании - это вторичная головная боль, вызванная недостатком жидкости в организме. Головные боли при обезвоживании могут быть относительно легкими или тяжелыми, как мигрень.
Поделиться на PinterestГоловная боль от обезвоживания может возникнуть после потоотделения, когда организм теряет жидкость, необходимую для правильного функционирования.Для правильного функционирования организму необходим правильный баланс жидкости и электролитов. Ежедневно организм теряет воду в результате повседневной деятельности, например, потоотделения и мочеиспускания.
В большинстве случаев количество потерянной жидкости легко компенсируется употреблением или употреблением богатой жидкостью пищи.Однако иногда организм теряет воду быстрее, чем ее можно восполнить.
В это время организм может обезвоживаться, что может привести к осложнениям, включая неприятные головные боли при обезвоживании.
Когда тело обезвожено, мозг может временно сокращаться или сокращаться из-за потери жидкости. Этот механизм заставляет мозг отделяться от черепа, вызывая боль и приводя к головной боли при обезвоживании.
После регидратации мозг набухает и возвращается в нормальное состояние, облегчая головную боль.
Головная боль при обезвоживании может ощущаться как тупая головная боль или интенсивная мигрень. Боль от обезвоживания может возникать спереди, сзади, сбоку или по всей голове.
В отличие от головной боли в носовых пазухах, человек, испытывающий головную боль от обезвоживания, скорее всего, не будет испытывать лицевой боли или давления. Также маловероятно возникновение боли в задней части шеи, как при головной боли напряжения.
Поскольку головные боли от обезвоживания возникают только тогда, когда тело обезвожено, симптомы обезвоживания будут проявляться вместе с головной болью.Эти симптомы включают следующее:
- сильная жажда
- снижение мочеиспускания
- темная моча
- спутанность сознания
- головокружение
- усталость
- сухость, липкость во рту
- потеря эластичности кожи
- низкое кровяное давление
- учащенное сердцебиение rate
Некоторые люди могут испытывать головную боль от обезвоживания, только если они сильно обезвожены. Эти люди могут не только иметь головную боль и некоторые из вышеперечисленных симптомов, но также испытывать некоторые другие симптомы.
Другие симптомы сильного обезвоживания, которые могут возникнуть у людей с обезвоживающей головной болью, включают:
- отсутствие потоотделения
- запавшие глаза
- лихорадку
- делирий
- потеря сознания
- сморщенная кожа
Головные боли от обезвоживания возникают только тогда, когда человек обезвоживается. Даже легкое обезвоживание может вызвать головную боль.
Обезвоживание происходит, когда организм не получает достаточно воды для удовлетворения своих потребностей. В большинстве случаев количество жидкости, поступающей в тело, соответствует количеству жидкости, выходящей из него. Вода выходит из организма через пот или мочеиспускание.
Однако определенные факторы могут этому помешать. Эти факторы увеличивают риск обезвоживания и включают следующие:
- диарея
- рвота
- сильное потоотделение в результате тяжелых упражнений или тепла
- лихорадка
- избыточное мочеиспускание
Факторы риска обезвоживания
.Скорее всего, каждый испытает хотя бы легкое обезвоживание. Однако некоторые люди подвержены более высокому риску обезвоживания.
К людям с повышенным риском обезвоживания относятся:
- людей, живущих на больших высотах
- младенцев и детей раннего возраста
- пожилых людей
- людей с хроническими заболеваниями, такими как диабет и заболевания почек
- людей, принимающих лекарства, увеличивающие диурез
- спортсменов на выносливость
- человек, живущих в жарком климате
Эти группы людей должны проявлять особую осторожность, чтобы оставаться должным образом гидратированным.
Чтобы вылечить головную боль от обезвоживания, устранение боли и обезвоживания - лучший способ получить облегчение.
Если у человека болит обезвоживание, он должен сделать следующее:
- увеличить потребление жидкости
- заменить потерянные электролиты спортивным напитком
- временно снизить физическую активность и избегать тепла, чтобы уменьшить потоотделение
Хотя вышеуказанные меры могут лечите обезвоживание, может потребоваться некоторое время, чтобы полностью облегчить головную боль от обезвоживания.
Для быстрого облегчения боли можно принять ацетаминофен или ибупрофен.
В определенных ситуациях, например при сильной рвоте или диарее, домашних средств может быть недостаточно, чтобы избежать сильного обезвоживания.
При сильном обезвоживании человек должен немедленно обратиться за медицинской помощью, чтобы предотвратить серьезные осложнения, такие как:
- повреждение почек
- судороги
- шок
Специалисты скорой медицинской помощи могут справиться с тяжелым обезвоживанием с помощью внутривенного введения жидкости и замены соли.
Лучший способ предотвратить головную боль от обезвоживания - это избегать обезвоживания. Чтобы предотвратить обезвоживание, можно предпринять следующие шаги:
Поделиться на Pinterest Во избежание обезвоживания рекомендуется пить достаточное количество жидкости в течение дня.- Пейте достаточно жидкости : Большинству людей требуется от 4 до 6 чашек воды в день, хотя некоторым людям может потребоваться больше или меньше.
- Ешьте продукты, богатые жидкостью : такие продукты, как огурцы, другие овощи и фрукты, содержат большое количество воды.
- Получайте достаточно жидкости в течение дня : Распределение потребляемой жидкости вместо того, чтобы пить ее сразу, помогает поддерживать гидратацию тела.
- Больше воды во время упражнений или в жаркую погоду : Во время сильного потоотделения, например, во время тяжелых упражнений или пребывания в жаркую погоду, потребность в воде увеличивается. Употребление большего количества воды в это время восполнит лишнюю жидкость, которая теряется с потом.
- Лечить первопричины обезвоживания : Лихорадка и инфекции могут вызвать потерю жидкости в организме больше, чем обычно.Устранение причин обезвоживания при одновременном увеличении потребления жидкости может помочь предотвратить обезвоживание.
- Избегайте напитков с кофеином и алкоголя : Кофеин и алкоголь могут увеличить диурез, что приводит к более высокому риску обезвоживания.
- Уменьшите физическую активность во время жары или при плохом самочувствии : Жара и болезнь могут увеличить потребность организма в жидкости. Тяжелые упражнения могут вызвать дополнительную потерю жидкости из-за пота, что может быть опасно в таких ситуациях.
Выполнение этих действий должно помочь предотвратить головные боли от обезвоживания.
Если человек испытывает не только эпизодическую головную боль от обезвоживания, ему следует проконсультироваться с врачом, чтобы исключить другие основные причины.
.









