Диоксид титана пищевой
Диоксид титана применяется в пищевой, кондитерской, и косметической продукции. Не существует однозначного мнения о том, оказывает ли он влияние на человеческий организм.
Содержание записи:
Что такое диоксид титана
Диоксид титана – продукт титановой промышленности. Он используется в качестве красителя, стабилизатора консистенции и пищевой добавки.
Вещество распространено на производстве из-за своих отбеливающих свойств.
Характеристики вещества Двуокись титана имеет ряд характеристик.
Основные из них:
- Производится вещество в виде кристаллов, и порошка (кристаллы имеют форму ромба).
- Вещество имеет белый цвет. Если нагреть, то он сменится на желтый. Добавка не имеет вкуса и запаха.
- Вещество не растворяется в воде.
- Химическая формула вещества – TiO2.
- Вещество получают из титаносодержащих руд.
Технологии получения, состав добавки
Существует 2 технологии получения диоксида титана:
- Из ильменитового концентрата.
- Из тетрахлорида титана.
Первый способ делится на 3 этапа.
- Сначала ильменитовый концентрат обрабатывают серной кислотой. Происходит деление на 2 компонента – сульфат железа и сульфат титана.
- Второй этап начинается с окисления железа. Используются специальные фильтры, которые помогут отделить сульфаты от шлама (отходов). На этом же этапе с помощью воды соли сульфата разделяются. Так образуются гидраты оскида титана.
- Последний этап заключается в нагревании гидрата оксида титана.
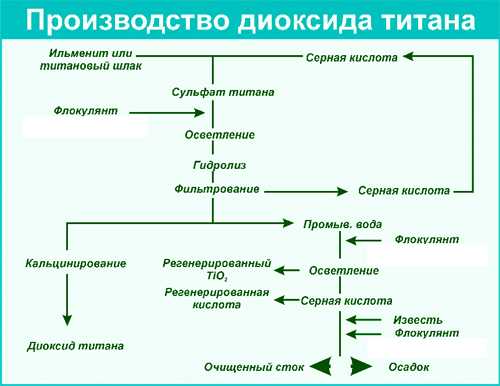
Технология получения оксида титана из тетрахлорида натрия осуществляется 3 методами:
- Разложение тетрахлорида натрия, как сложного вещества, на части с помощью водного раствора (гидролиз).
- Термообработка тетрахлорида натрия.
- Гидролиз парофазный.
Область применения
Диоксид титана (влияние на организм человека описано далее в статье) прочно занял свое место во многих сферах промышленности из-за своих окрашивающих свойств.
Где его применяют:
Польза и вред. Влияние на организм
Диоксид титана широко используется в ряде производств, но ведутся споры о том, какое влияние оказывает вещество на организм человека.
В пищевой промышленности
Диоксид титана, влияние на организм человека которого до конца не изучено, используется повсеместно. Сегодня нет единого мнения насчет безопасности Е171. Результаты исследований, проводимых в конце прошлого века в Европе, не говорят о вреде диоксида титана для человеческого организма. Поэтому в 1997 г. краситель внесен в перечень безопасных веществ.
Скептики утверждают, что при регулярном попадании в организм, добавка оказывает отрицательное влияние на генетику человека. Но в 2016 году Европейское агентство по безопасности пищевых продуктов сделало заключение о том, что пищевая добавка не несет вреда человеку при попадании в организм с пищей.
Профессор Роберт Шистл из Калифорнийского университета ведет исследования о добавке Е171 в продуктах питания. Проводя опыты на крысах, были замечены отрицательные изменения в их организме. Профессор объясняет это тем, что наночастицы вещества не выводятся полностью. Оседая, они наносят повреждения белковым цепочкам.
В каких продуктах можно встретить Е171:
- Морепродукты белого цвета, крабовые палочки.
- Детское питание.
- Завтраки быстрого приготовления.
- Жевательная резинка.
- Конфеты.
- Белый шоколад.
- Молочная продукция – молоко, кефир, йогурт, сливки, сыр.
- Полуфабрикаты.
- Мороженое.

Диоксид титана добавляют в муку при изготовлении теста для пельменей, макарон и других изделий. Таким образом производитель улучшает внешний вид товара. Метод экономически эффективен. Производитель на выходе получает продукт товарного вида, не вкладывая большого количества денежных средств.
В кондитерской индустрии
Кондитеры стараются помимо уникальных вкусовых качеств предложить потребителю десерты, которые выглядят идеально. Различные красители используются для придания цвета бисквитам, кремам, мастике. Диоксид титана в кондитерском деле используется для придания белоснежного оттенка без дополнительного запаха или вкуса, который может испортить десерт.
Для таких целей он продается в виде порошка прозрачного цвета с мелкими кристаллами. Диоксид титана устойчив к воздействию химических веществ. Свойство позволяет смешивать краситель с ингредиентами, у которых сложный химический состав.
Широко распространено применение красителя в изготовлении имбирных пряников. Украшение из глазури делают из айсинга – смеси сахарной пудры, сухого белка, диоксида титана и других добавок. Диоксид титана здесь позволит сделать глазурь привлекательнее. Сухой белок взбитый с сахарной пудрой не даст такого цвета. Без добавок глазурь имеет серый подтон, который выглядит не так аппетитно, как белый.
В косметологии
Диоксид титана (влияние на организм человека через лекарственные средства описано далее в статье) содержится в большинстве декоративных и уходовых средств.
В чем польза диоксида титана в косметике:
- Окрашивающие свойства. Вещество почти всегда применяется в декоративных тонирующих средствах – тональный крем, пудра, румяна, хайлатеры, консилеры. Диоксид титана помогает добиться нужного цвета средства путем соединения с другими окрашивающими компонентами.

- SPF-защита. Все средства, предназначенные для защиты кожи от ультрафиолетовых лучей, содержат диоксид титана. Все дело, в кристаллах вещества, которые помогут уменьшить их негативное воздействие.
- Улучшает консистенцию средства. Он выполняет роль загустителя, придет вязкость продукту.
Диоксид титана широко применяется и в детской косметике. Но проводимые исследования говорят о возможно вреде вещества в непищевой промышленности.
Существует мнение о том, что возможно изменение гормонального фона при воздействии диоксида титана на кожу человека. Но достоверных данных на сегодняшний день нет, поэтому ни одна экспертная комиссия не может сделать точный вывод.
В медицине. Зачем фармацевтам TiO2?
Сейчас недостаточно информации о применении диоксида титана в медицинских препаратах. В статье «Распространенность, применение и патологические эффекты от диоксида титана» за 2016 год говорится о том, что вещество часто включается не только в таблетки (капсулы) белого цвета, но и препараты, окрашенные в другие цвета.
Желатиновые капсулы на 112 мг желатина содержат 0,217 мг диоксида титана. Проведены исследования лекарственных средств. Изучены составы нескольких препаратов разного цвета. Результаты говорят о том, что в их составе всегда есть диоксид титана.
Если брать во внимание факт, что есть риск негативного влияния вещества на организм человека, то прием таких препаратов может быть опасен. Навредить TiO2 способен при регулярном поступлении в организм, ведь некоторые люди вынуждены длительное время принимать лекарственные средства, особенно при хронических заболеваниях.
В других сферах
Более половины от всего производства с использованием диоксида титана приходится на изготовление лакокрасочной продукции. В их список входят краски, лаки, эмали, шпатлевки, растворы для грунтования. Столь широкое применение объясняется отличными окрашивающими свойствами и безвредностью вещества.
Также поверхность, обработанная продуктом с диоксидом титана защищена от ультрафиолетовых лучей. Благодаря этому, она не желтеет со временем.
20% от всего объема производства вещества приходится на изготовление пластмассовых изделий.
Сюда входят элементы мебели, детали автомобилей, оконный пластик. Здесь диоксид титана нужен для сохранения стойкости изделий и деталей к агрессивному воздействию света, температуры и погодных условий.
Вещество постоянно применяется на производстве бумажных изделий (около 14% от производства красителя во всем мире идет в эту отрасль). Отмечается, что в ближайшие года в несколько раз вырастет производство ламинированной бумаги, в состав которой также входит двуокись титана. Другой альтернативы для производства бумаги сегодня нет.
Вред от диоксида титана возможен при постоянной работе с добавкой, что возможно на производстве. Готовые изделия из диоксида титана не несут вреда организму человека, так как исключается возможность вдыхания вещества.
При работе с лакокрасочной продукцией следует пользоваться респираторами, установить четкое время нахождения рядом с окрашенными объектами.
Как обезопасить себя от наночастиц
Сегодня у потребителя нет возможности исключить диоксид титана из своей жизни, так как он содержится в пищевой продукции, предметах гигиены. На него нет запрета в РФ. Пока что нет достоверных данных о вреде добавки.
Диоксид титана и диабет
Статья, опубликованная в Chemical Research in Toxicology рассказывает об опытах , в которых принимали участие 8 человек, страдающие диабетом и 3 здоровых человека. У них взяли образцы тканей поджелудочной железы.
По результатам анализов можно увидеть, что у всех больных в тканях поджелудочной железы обнаружено большой количество монокристаллов диоксида титана (на 1 г ткани приходилось до 100 000 единиц).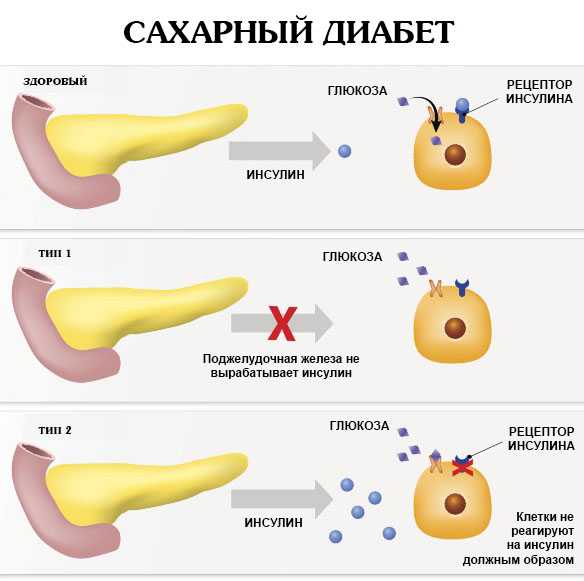
Учитывая информацию о том, что с каждым годом растет количество людей, страдающих диабетом, так же, как и растет количество употребляемого диоксида титана, беспокойство ученых выглядит обоснованным. Сейчас ведутся масштабные исследования по этому поводу.
Риск для здоровья, последствия и осложнения
Отмечается, что диоксид титана, как и другие добавки, часто становится источником аллергии у детей из-за добавления большого количества красителей в детское питание. Поэтому рекомендуется до 6 месяцев поддерживать грудное вскармливание, а при введении прикорма избегать продуктов с добавками и красителями.
Особенно, если у ребенка или его родителей есть склонность к гиперчувствительной реакции. При обследовании взрослых-аллергиков обнаружено, что у 27% больных есть непереносимость пищевых красителей, в том числе диоксида титана. Такой показатель указывает на то, что белый краситель является аллергенным и астмогенным.
Часто диоксид титана вызывает реакцию у больных бронхиальной астмой. Особенно, если пациент вынужден принимать на постоянной основе лекарственные средства.
Результаты исследований говорят о потенциальной опасности добавки для определённых групп людей.
Повод для беспокойства появился после проведения опытов с крысами. Выяснилось, что Е171 влияет на наследственность. При попадании в организм, наночастицы блуждают по нему, не скапливаясь в одном месте.
Таким образом добавка воздействует на хромосомы. Еще замечено, что наночастицы, попадая в клетки, нарушали их работу, возникало воспаление. Таким образом диоксид титана провоцировал возникновение злокачественных образований.
Исследования продолжаются, поэтому добавка разрешена по сегодняшний день. Высокая опасность диоксида титана отмечена лишь для людей, чья профессиональная деятельность связана с постоянным контактом с веществом.
Диоксид титана – распространенная добавка, которая применяется во многих сферах жизни человека. Чтобы понять, насколько опасно ее влияние на организм, нужны масштабные исследования, которые займут не один год. На данный момент нет однозначного мнения о ее безопасности.
Оформление статьи: Владимир Великий
Видео о вреде диоксида титана
Диоксид титана вызывает рак:
Диоксид титана в продуктах питания - TDMA
Диоксид титана широко используется в пищевой промышленности в качестве красителя E171.
Диоксид титана - яркое, белое соединение; это использовалось как жизненно важный краситель во многих отраслях промышленности в течение приблизительно 100 лет.
Он придает вибрацию и текстуру многим продуктам и широко используется в пищевой промышленности.
- Диоксид титана, известный в пищевой промышленности как краситель E171, использовался в течение более пяти десятилетий.
- Его можно использовать для придания пище великолепного вида, а TiO 2 , используемый в потребительской упаковке, может помочь защитить продукты от разложения.
- Он плохо растворим и плохо усваивается организмом; не было показано, что его употребление в пищу оказывает негативное воздействие на здоровье.
Введение
Диоксид титана используется в пищевой промышленности, чтобы еда выглядела ярче и привлекательнее.
Природный материал, диоксид титана, используемый в пищевых продуктах, представляет собой очищенную форму оксида титана, девятого наиболее распространенного элемента на планете.
Известный как TiO 2 или пищевой продукт в качестве пищевого красителя E171, он соответствует действующему европейскому законодательству, что означает, что он не содержит веществ, которые считаются опасными для потребителей.
Какой тип пищи используется в E171 и почему?
E171 используется в различных продуктах, от сладостей до плавленых сыров.
Исследования показывают, что потребители чаще покупают и едят продукты более яркого или более яркого цвета, поскольку они выглядят более свежими. TiO 2 также придает текстуру пищевым продуктам и часто используется в качестве средства против слеживания.
E171 часто используется для придания естественной белизны и непрозрачности продуктам, таким как мороженое и глазурь на пирожных, помогая создавать великолепно выглядящую еду. [1]
Пищевой диоксид титана имеет давнюю историю, помогая сделать наши блюда и закуски эстетически привлекательными.Производители пищевых продуктов уже более 50 лет используют его в утвержденных целях.
E171 безопасно ли есть?
Да - при употреблении в пищу диоксид титана не попадает в кровоток и проходит через пищеварительную систему без изменений и не всасывается.
E171 прошел строгие европейские испытания и классификацию, которые доказали, что не было обнаружено, что диоксид титана сохраняется или накапливается в организме человека или окружающей среде.
TiO 2 одобрен для использования в качестве красителя. Чтобы он имел эстетическую привлекательность в пищевых продуктах, он должен рассеивать видимый свет. Это то, что заставляет пищу казаться белее или цвета ярче; чтобы это произошло, частица должна быть 200-350 нм (нанометр). Наночастицы определяются как составляющие 100 нм или менее или специально сконструированные как наночастицы. Следовательно, использование нано-TiO 2 было бы бесполезно для производителей, стремящихся улучшить внешний вид продуктов питания.
Тем не менее во Франции возникло беспокойство по поводу того, используются ли наночастицы в пище. Французское агентство по продовольствию, охране окружающей среды и гигиене труда и технике безопасности (ANSES - Agence Nationale de Sécurité Sanitaire, Alimentation, Environment et du Travail) призвало к дополнительным исследованиям биологического воздействия наночастиц в пищевых продуктах. [2] [3]
За более чем 50 лет использования в качестве пищевого красителя не было выявлено никакой поддающейся проверке связи между общим потреблением диоксида титана и плохим состоянием здоровья людей.
В июне 2018 года, после запроса Европейской комиссии о предоставлении научного заключения, Европейское агентство по безопасности пищевых продуктов (EFSA) подтвердило их мнение о том, что данные по E171 в пищевых продуктах не показывают никаких проблем со здоровьем для потребителей.
Первоначальное мнение, опубликованное в 2016 году, было частью переоценки всех пищевых красителей, разрешенных к использованию до 2009 года. Затем EFSA рассмотрело последние исследования по E171 в рамках этого исследования. В своем обзоре EFSA обнаружило, что на безопасность E171 не влияет размер частиц, поскольку он не всасывается в организм человека. [4] Поэтому они пришли к выводу, что не было причин менять предыдущее мнение о том, что E171 безопасен для использования в пищевых продуктах. [2] [5]
Что эксперты говорят о Е171 в еде?
В 2015 году группа исследователей из Агентства по исследованиям в области пищевых продуктов и окружающей среды в Великобритании, Института пищевых продуктов в Научно-исследовательском центре Tübitak Marmara в Турции и Института безопасности пищевых продуктов RIKILT в Нидерландах провели исследование перорального потребления нано. и более крупные частицы TiO 2 .
Их исследование показало, что не будет «значительного внутреннего воздействия на потребителя наночастиц». [6]
Эндрю Мейнард, профессор наук об окружающей среде Мичиганского университета, также не обеспокоен своими свойствами и воздействием на человека. В статье за 2015 год он сказал: «TiO 2 - довольно скучный химикат. Не растворяется в воде. Это не особенно реактивно. Он не легко усваивается организмом из пищи. И это, кажется, не вызывает неблагоприятных проблем со здоровьем.” [7]
Безопасный и полезный пищевой ингредиент
Широкий ассортимент пигментов и добавок используется для того, чтобы еда выглядела более привлекательной для потребителей.
E171, тем не менее, является наиболее эффективным белым красителем в пищевых продуктах - фактически он в пять раз более эффективен, чем альтернативы, такие как диоксид кремния или карбонат кальция. Замена его альтернативой может также привести к новым, неисследованным, опасностям.
Используя E171, производители продуктов питания могут уменьшить количество красителя, которое они используют для создания привлекательной и безопасной пищи.
,
диоксид титана в качестве пищевой добавки
1. Введение
Диоксид титана (TiO 2 ) представляет собой оксид переходного металла с двумя основными областями применения в качестве пигмента или фотокатализатора во многих секторах, включая здания (самоочищающиеся окна, цементы, краски и краски против обрастания), бумажная промышленность, косметика (солнцезащитные средства и зубная паста), фармацевтика (таблетки), продукты питания (красители) и другие (система очистки воздуха, каучуки, чернила и керамика). Пигментные аппликации являются безусловно самым важным применением TiO 2 .Интерес к TiO 2 заключается в рассеянии видимого света, контролируемом его высоким показателем преломления и его гранулометрией (размером и формой). Эти требования также распространяются на продукты питания, где TiO 2 обеспечивает отбеливающий эффект. Хотя это соединение очень долгое время использовалось в пищевых продуктах (с недавним повторным одобрением Европейского агентства по безопасности пищевых продуктов для разрешенного использования в пищевых продуктах), использование диоксида титана в пищевых продуктах вызвало некоторые опасения у западного населения из-за присутствию наночастиц, то есть частиц, имеющих один или несколько внешних размеров в диапазоне размеров 1–100 нм.Эта обзорная глава предназначена для аудитории практикующих исследователей, ученых и аспирантов, которые заинтересованы в пищевых применениях этого соединения и причинах противоречий.
2. Использование TiO 2 в пищевых продуктах: функции, свойства и безопасность
Диоксид титана - это пищевая добавка без какой-либо пищевой ценности, добавляемая в обработанные пищевые продукты для обеспечения отбеливающего эффекта. Впервые он был одобрен для использования в пищевых продуктах Управлением по контролю за продуктами и лекарствами США (FDA) в 1966 году, а затем Европейским союзом в 1969 году на основе Кодекса Алиментариус Продовольственной и сельскохозяйственной организации / Всемирной организации здравоохранения (ФАО / ВОЗ).При использовании в качестве пищевого красителя он маркируется как E171 в Европе или INS171 в США. В других областях его также называют титановым белым, пигментным белым 6 или CI 77891. Время от времени его переоценивали на предмет незначительного пересмотра спецификаций в 2006, 2009, 2010 и 2012 годах. В частности, Европейский союз принял решение в 2006 году. разрешить кристаллическую структуру рутила в пищевых продуктах в дополнение к ранее утвержденной форме анатаза (COMMISSION DIRECTIVE 2006/33 / EC от 20 марта 2006 г.). Затем он был подвергнут углубленной оценке в 2016 году (EFSA 2016).
2.1. Пищевые категории с разрешенным использованием TiO 2
Пищевые красители Группы II, включая диоксид титана, разрешены для большинства пищевых категорий 1,2, таких как (i) молочные продукты и аналоги (кисломолочные продукты с ароматизированными добавками и некоторые кремы). ), (ii) сыр и сырные продукты, такие как незрелый сыр (Моцарелла, Кодекс Стан 262-2006 или свежий сыр, Кодекс Стан 221-2001), цедра съедобного сыра, сывороточный сыр, плавленый сыр, сырные продукты и молочные аналоги, включая отбеливатели для напитков , (iii) съедобные льды, (iv) кондитерские изделия (жевательная резинка, украшения, покрытия и наполнители не на фруктовой основе), (v) сурими и аналогичные продукты и заменители лосося, (vi) приправы и приправы, горчица, супы и бульоны и соусы, и (vii) пищевые добавки (Официальный журнал Европейского Союза, № 1129/2011).Этот список, несмотря на его длину, на самом деле не является исчерпывающим, и весь список с некоторыми ограничениями использования доступен на специализированных веб-сайтах.
Диоксид титана был фактически идентифицирован в жевательных резинках [1–3], кондитерских изделиях [4, 5], соусах и приправах [5], немолочных сливках [2, 5] и в пищевых добавках [6]. Согласно базе данных, собирающей информацию о новых продуктах (278 705), представленных на рынке в 62 крупнейших странах мира, использование TiO 2 постоянно увеличивалось до 2014 года, представляя собой маркировку более 3500 продуктов питания или напитков (Mintel GNPD база данных цитируется Европейским агентством по безопасности пищевых продуктов EFSA [7]).Если TiO 2 обнаружен только в 1,3% новых продуктов, он, тем не менее, содержится в 51% жевательных резинок, 25% палочек, жидкости и спреев, 21% смешанного ассортимента, 10% пастилок, жевательных резинок, желе и жевательных конфет. и 10% леденцов на палочке [7]. Жевательные резинки и кондитерские изделия, в том числе пастилки, жевательные резинки, желе и жевательные конфеты, представляют собой наиболее распространенные категории продуктов питания, как по количеству продуктов, маркированных TiO 2 на категорию, так и по количеству новых продуктов, доступных на рынке. Торты и пирожные представляют вторую категорию важности.Этот сценарий должен регулярно совершенствоваться, так как состав пищевых продуктов может изменяться [8, 9].
2.2. Уровни потребления
Количество TiO 2 , потребляемого в США на ежедневной основе, оценивалось в 0,2–0,7 мг TiO 2 на кг массы тела в день (мг / кг массы тела в сутки), тогда как Население Великобритании и Германии потребляет около 1 мг TiO 2 / кг массы тела в день [4, 10]. Эти данные были уточнены для всех категорий продуктов питания, подгрупп населения и сценариев воздействия в Нидерландах [11, 12], в Германии [10] и в Европе [7].Например, оценка среднего долгосрочного воздействия диоксида титана (E 171) колеблется от 0,5 (верхний предел 1,1 мг / кг массы тела / сутки) для пожилых людей до 1,4 мг / кг массы тела / сутки (верхняя граница уровня 3,2 мг / сутки). кг массы тела в день для детей в Нидерландах [12], что близко к оценке в Германии [10].
Каким бы ни был сценарий воздействия и методологический выбор, крупнейшими потребителями TiO 2 являются дети (3–9 лет) и подростки (10–17 лет) [4, 7, 10–12]. В сценарии воздействия EFSA вклад жевательных резинок является слабым по сравнению с другими кондитерскими изделиями, включая освежающие дыхание микросладкие сладости или соусы, салаты и соленые сэндвич-спреды [7].В исследовании, основанном на Национальном обзоре потребления продуктов питания в Нидерландах, продукты, наиболее способствующие потреблению TiO 2 для детей младшего возраста (2–6 лет), представляют собой кондитерские изделия (сладости, шоколадные изделия и жевательные резинки) и тонкие хлебобулочные изделия ( печенье). Для 7–69-летних и пожилых (70+) идентичные продукты питания идентифицируются, но в другом порядке убывания: жевательные резинки, сливки для кофе, соусы, а затем хлебобулочные изделия. Поскольку 10 продуктов питания, наиболее способствующих потреблению TiO 2 , составляют 55%, мы должны помнить, что потребление TiO 2 распределяется по многим продуктам, причем жевательные резинки приносят лишь на несколько процентных пунктов больше, чем другие категории продуктов питания [11] ,В аналогичном исследовании, проведенном в Германии, наиболее полезными для общего потребления титана взрослыми являются пищевые соусы, приправы, безалкогольные напитки и сыр (более 75%) [10]. В дополнение к пищевым продуктам таблетки, такие как лекарства и пищевые добавки, содержат TiO 2 до 3,6 мг / г [13], что приводит к увеличению общей суточной дозы TiO 2 .
2.3. Спецификации TiO 2 для пищевых применений
В дополнение к соблюдению разрешенного использования в вышеупомянутых категориях пищевых продуктов, порошок, введенный в эти пищевые продукты, должен соответствовать пяти критериям, а именно путям синтеза, структуре, чистоте, количествам и безусловно, отсутствие токсичности (Регламент Комиссии (ЕС) № 231/2012 и Объединенный комитет экспертов ФАО / ВОЗ по пищевым добавкам (JECFA) [14]).Сначала эти критерии описываются в соответствии с рекомендованными спецификациями, затем они комментируются и обсуждаются с литературными данными.
2.3.1. Синтез: сульфатный и хлоридный процессы
В зависимости от желаемой кристаллической фазы диоксид титана образуется либо сульфатным, либо хлоридным процессом. Фаза анатаза из диоксида титана может быть получена только сульфатным способом, тогда как рутиловая фаза диоксида титана может быть получена из обоих процессов, но хлоридный процесс является более устойчивым и обеспечивает кристаллы с более узким распределением частиц по размерам, чем сульфатный процесс [15 ].
Вкратце, в сульфатном процессе серная кислота используется для переваривания ильменитовой руды (FeTiO 3 или FeO / TiO 2 ) в сульфат железа (II) и соль титана (Ti (SO 4 ) 2 ). Сульфат железа (II) удаляют из раствора после разбавления и кристаллизации / фильтрации с получением только соли титана (Ti (SO 4 ) 2 ) в растворе для разложения. Затем некоторые микрокристаллы анатаза вводятся в раствор, который затем гидролизуется в тщательно контролируемых условиях с образованием кристаллов анатаза.Затем они фильтруются, промываются, прокаливаются и тонко измельчаются [13, 15, 16]. Хлоридный процесс, который генерирует кристаллы рутила, состоит из хлорирования руды в хлориды титана и железа, которые затем разделяются перегонкой. Затем хлорид титана обрабатывают для удаления примесей и окисляют в реакторе с регулируемым пламенем с получением кристаллов рутила TiO 2 с желаемым размером [15, 16]. Кроме того, диоксид титана может быть покрыт небольшими количествами оксида алюминия и / или диоксида кремния для улучшения технологических свойств продукта, которые описаны как блокаторы фотокаталитической активности [14].
Некоторые рутильные сорта диоксида титана в виде тромбоцитов производятся с использованием слюды в качестве шаблона. Специфические свойства этого пигмента (интерференционный цвет) контролируются толщиной слоя диоксида титана с покрытием и процессом нанесения покрытия [13].
2.3.2. Кристаллографическая структура
В настоящее время формы E171 состоят в основном из чистого анатаза и / или рутила. До 2006 года только форма анатаза была разрешена для применения в пищевых продуктах. Рутилу было разрешено заменять анатаз в пищевых продуктах, особенно в пленочных покрытиях для пищевых добавок в таблетках и пищевых продуктах [13].Как в анатазной, так и в рутиловой структурах основной строительный блок состоит из атома титана, окруженного шестью атомами кислорода (рис. 1). Структуры различаются по искажению и сборке октаэдров [17]. В рутиле эти октаэдры соединены своими углами и краями (рис. 1), а размеры элементарной ячейки составляют a = b = 4.587 и c = 2.953 Å. Для анатаза октаэдры связаны через ребра и плоскости, образуя элементарную ячейку с , = , = 3.782 и с = 9,502 Å (рис. 1). В каждой структуре две связи между титаном и апикальными атомами кислорода немного длиннее других (1,983 и 1,946 Å в структуре рутила, 1,966 и 1,937 Å в структуре анатаза). Кроме того, значительное отклонение от угла связи 90 ° наблюдалось в анатазе (92,6 и 102,3 Å, рис. 1).
Рисунок 1.
Объемные структуры (A) анатаза, (B) рутила с (C) связями, длинами и углами октаэдрически координированных атомов Ti в анатазе, упорядоченные из расположения Diebold [17] и (D) атомов на (101) поверхность анатаза после адсорбции и диссоциации воды с Ti (шарики, заполненные серым), O из структуры TiO2 (пустые шарики), O из воды (большие заштрихованные шарики) и H из воды (маленькие заштрихованные шарики).
Хотя обе формы разрешены в пищевых продуктах, характеристика образцов в американских и европейских лабораториях показывает, что анатаз является преобладающей кристаллической структурой, обнаруженной в пищевых продуктах [1, 3, 4, 18–20]. Например, пять из шести жевательных резинок содержали TiO 2 в качестве анатаза, и только одна содержала смесь анатаза и рутила [1]. Таким образом, сульфатный процесс, по-видимому, является преобладающим для получения пигментного TiO 2 для пищевых применений.
В объемной структуре катионы титана имеют координационное число 6, означающее, что анионы кислорода имеют координационное число 3, возникающее в результате тригональной плоской координации (рис. 1).Но на поверхности анионы и катионы, как говорят, «координационно ненасыщены». Низкоординированные катионы (Ti 5c ), таким образом, действуют как кислоты Льюиса (акцептор электронной пары) и способны взаимодействовать с донорами электронов, такими как H 2 O. Аналогично, атомы О с двойной координацией (O 2c ) и названы мостиковые атомы кислорода являются основаниями Льюиса и способны взаимодействовать с акцепторами электронов, такими как H + . Таким образом, как только поверхность оксида подвергается воздействию влаги, присутствующей в атмосфере, она полностью покрывается адсорбированной водой и гидроксильными группами.Молекулярно адсорбированная вода в вакансиях частично диссоциирует с образованием двух видов гидроксильных групп: (1) концевых гидроксилов, которые адсорбируются на сайтах Ti 5c (TiOH), и (2) мостиковых гидроксилов, которые возникают в результате протонирования атомов O 2c (Ti 2 OH) [21]. Поверхностные гидроксильные группы способны вести себя как кислотные или щелочные центры Бренстеда, когда частицы TiO 2 диспергированы в воде.
2.3.3. Чистота
В Европе, а также в США содержание диоксида титана должно быть не менее 99.0% на основе оксида алюминия и диоксида кремния (постановление Комиссии (ЕС) № 231/2012), а количество глинозема и / или диоксида кремния не должно превышать 2%. Исследованные образцы соответствовали этим спецификациям [18–20, 22]. Кроме того, Комиссия указывает, что потери при сушке должны быть ниже 0,5% (105 ° C, 3 часа), а потери при воспламенении должны составлять менее 1,0% (800 ° C) в пересчете на сухое вещество. Кислоторастворимые вещества должны составлять менее 0,5% (менее 1,5% для продуктов, содержащих глинозем или диоксид кремния), а водорастворимые вещества должны составлять менее 0.5%. Для примесей, растворимых в 0,5 н. Соляной кислоте, их количество должно быть ниже 1 мг / кг для мышьяка, кадмия и ртути, ниже 2 мг / кг для сурьмы и ниже 10 мг / кг для свинца. Эти спецификации очень похожи на те, которые даны JECFA [14].
2.3.4. Суммы
В Европе разрешено использование диоксида титана при количественном уровне , тогда как в США он используется в пределах 1% от веса пищи. Хотя в Европе не указывается максимальный уровень использования этой добавки, ее следует использовать в соответствии с надлежащей производственной практикой (GMP), то есть на уровне, не превышающем необходимый для достижения намеченного технического эффекта.Это решение было мотивировано тем фактом, что TiO 2 рассматривался как неактивный ингредиент в пище человека, и что ни существенное поглощение, ни хранение тканей после приема TiO 29000 было невозможно. В своем последнем докладе Группа EFSA пришла к выводу, что окончательные и надежные данные о репродуктивной токсичности E 171 еще не доступны, чтобы позволить Группе установить приемлемый суточный прием (ADI) [7].
Количественная оценка TiO 2 в коммерческих продуктах показывает, что жевательные резинки являются продуктами питания, наиболее богатыми диоксидом титана [2, 4].Они содержат от 0,7 до 5,4 мг Ti / г пищи. Следующая категория - сладости с 0–2,5 мг Ti / г пищи, а затем выпечка с 0–0,5 мг Ti / г пищи [2]. В отчете EFSA, включающем более многочисленные категории продуктов питания и данные, представленные промышленностью, самый высокий максимальный уровень содержания TiO 2 приходится на украшения, покрытия и наполнители [7] с 20 мг TiO 2 / г пищи, что соответствует 12 мг Ti / г пищи, немного выше максимального уровня, сообщенного для жевательных резинок (16 мг TiO 2 / г, т.е.9,6 мг Ti / г пищи). Учитывая средний уровень использования, он немного выше в обработанных орехах (3,8 мг Ti / г пищи), чем в жевательных резинках (3,4 и 2,8 мг Ti / г пищи, в зависимости от производителей), пищевых добавках (2,8 мг Ti / г). продукты питания) и салаты и соленые сэндвич-спреды (2,5 мг Ti / г пищи).
2.3.5. Безвредность TiO 2
С начала 1960-х годов TiO 2 считается безопасным для использования в пищевых продуктах. С тех пор некоторые авторы поставили этот факт под сомнение [23].В недавней переоценке диоксида титана (E171) в качестве пищевой добавки [7] Группа EFSA оценила, что поглощение перорально вводимых частиц TiO 2, включая микро- и наноразмерные (менее 3,2% по массе) фракции были незначительными, достигая не более 0,02–0,1% от введенной дозы. Они также указали, что не ожидается никакого нежелательного эффекта, возникающего в результате возможного накопления поглощенных частиц, на основании результатов долгосрочных исследований, которые не выявили никакой токсичности вплоть до самой высокой введенной дозы.Наименьшее значение, обнаруженное в литературе для уровней нежелательных побочных эффектов (NOAEL), составило 2250 мг TiO 2 / кг массы тела в сутки.
2.4. Другие физико-химические свойства пищевого TiO 2
Диоксид титана нерастворим в воде, соляной кислоте, разбавленной серной кислоте и органических растворителях. Он медленно растворяется в плавиковой кислоте и горячей концентрированной серной кислоте. Он практически нерастворим в водных щелочных средах (COMMISSION DIRECTIVE 2008/128 / EC).
Физико-химические характеристики частиц, в том числе морфология (сферическая и цилиндрическая), размер (меньше или больше <100 нм), поверхностный заряд (отрицательный, нейтральный или положительный), структура (кристалличность), агломерация (агрегаты, агломераты и первичные частицы ) и поверхностный состав, предполагается или показано, что они играют роль в поглощении наночастиц через кишечник [24].Таким образом, пять критериев, описанных ранее, должны быть дополнены более глубокой характеристикой пищевого TiO 2 , которой, к сожалению, уделяется гораздо меньше внимания.
2.4.1. Содержание наночастиц и распределение по размерам
. Принимая во внимание использование в качестве отбеливающего агента TiO 2, ожидается, что распределение по размерам будет центрировано на среднем размере пигмента 250 нм для получения оптимального эффекта [25]. Однако средний размер пищевого TiO 2 фактически составляет от 106 до 145 нм, а распределение по размерам составляет от 30 до 300 нм [4, 18, 19, 26, 27] или от 60 до 300 нм [2 ].Например, несколько диапазонов распределения размеров и средних размеров представлены на рисунке 2. В целом, они охватывают от 30 до 300 нм. В этих партиях доля наночастиц (<100 нм) составляла от 17 до 36%. Во всем наборе образцов, исследованных в литературе, распределение наночастиц по размерам, выраженное в количестве, всегда было меньше 50%. В жевательных резинках эта доля составляет 43,7% [1].
Рисунок 2.
Распределение по размерам (пунктирные прямоугольники), средний размер (черные точки) и процентное содержание наночастиц в количестве (%) частиц пищевого TiO2, характеризуемых (E) Dudefoi et al.[18] и (S) Yang et al. [19]. Средние размеры распределения варьируются от 106 до 145 нм.
Чтобы определить сценарий подверженности, эквивалентная масса НП более интересна. Согласно нескольким исследованиям, масса (мас.%) Наночастиц, присутствующих в E171, находится в диапазоне от 0,31 до 12,5% [7, 10, 11, 18]. Это объясняет некоторые расхождения в различном воздействии наночастиц TiO 2 в литературе и, например, фактор 10 в оценке потребления NP между исследованиями Rompelberg et al.[11], которые рассматривали 0,31% НП и оценку EFSA [7], которые использовали весовое соотношение 3,2%.
2.4.2. Удельная площадь поверхности
Удельная площадь поверхности (SSA) материала определяется как общая площадь поверхности материала на единицу массы. Он обратно пропорционален размеру частиц: чем меньше размер материала, тем выше его удельная поверхность и его реакционная способность по отношению к окружающей среде. SSA обычно определяют из изотерм объемной адсорбции при 77 К газообразного азота с последующей адсорбционной обработкой Брунауэра-Эммета-Теллера (BET) (так называемая изотерма N 29-BET), предполагая наличие многослойного адсорбата.Удельная поверхность пищевого TiO 2 составляет от 8,6 до 10,7 м. 2 / г [18, 20], в среднем 9,3 м. 2 / г. Эти значения являются довольно низкими по сравнению, например, с противозадирными агентами, которые составляют около 200 м 2 / г. Это указывает на то, что TiO 2 имеет низкую поверхность контакта с окружающей средой.
2.4.3. Химический состав поверхности
Установлено, что поверхности пищевого TiO 2 в основном покрыты гидроксильными группами [18], фосфатными группами [18, 19] и ионами калия [18].Некоторые фосфатные группы могут не быть тесно связаны с поверхностью и высвобождаться после стирки [19]. В некоторых случаях TiO 2 был покрыт кремнеземом [18] и глиноземом [19], таким образом модифицируя химию поверхности.
2.4.4. Поверхностный потенциал
Как упоминалось ранее, поверхностные гидроксильные группы, которые ведут себя как кислотные или щелочные центры Бренстеда, придают заряд поверхности частицы. Когда частицы TiO 2 диспергированы в водной среде, этот заряд в основном определяется двумя явлениями: протонированием / депротонированием поверхностных гидроксилов, контролируемым рН, и адсорбцией ионов электролита [28].Электростатический потенциал, экспоненциально затухающий вдали от поверхности, связан с общим распределением заряда в межфазной области. Экспериментальное определение этого потенциала, называемого дзета-потенциалом, обычно выполняется измерениями электрофоретической подвижности. Все модели, преобразующие электрофоретическую подвижность в дзета-потенциал, рассматривают идеальные сферические частицы, что является деликатным предположением в случае TiO 2 из-за образования агломератов с несферическими частицами (следующий раздел).Существует улучшенная модель для преобразования измерений электрофоретической подвижности в значения дзета-потенциала с учетом влияния размера агломерата и поверхностной проводимости TiO 2 [29]. Значения дзета-потенциала зависят не только от параметров, контролирующих поверхностные заряды, а именно от природы среды, в которой диспергированы частицы TiO 2 (pH, ионная сила и адсорбированные частицы [20]), но и от размера первичных частиц [29 , 30] и кристаллографическое лицо [31].Точка, в которой дзета-потенциал равен нулю, определяет изоэлектрическую точку (IEP).
Изоэлектрическая точка пищевых образцов TiO 2 , измеренная с помощью измерений электрофоретической подвижности, была найдена между 3 и 4 для большинства образцов (таблица 1), намного ниже классического значения для анатаза. Такое различие объясняется наличием фосфатных групп на поверхности частиц TiO 2 [18, 19] или кремнеземным покрытием [18], которые снижают изоэлектрическую точку в сторону более низких значений pH.Интересно отметить, что изоэлектрическая точка пищевого образца, измеренная с помощью электроакустических измерений, дала значение 5,1 [20], что близко к классическим данным для анатаза. Для всех этих образцов дзета-потенциал их суспензий варьируется от -35 до -45 мВ при физиологическом значении рН. Faust et al. сравнили дзета-потенциал пищевого TiO 2 и экстракта жевательной резинки и обнаружили, что экстракт жевательной резинки имел значительно более отрицательный потенциал (-45 мВ при pH 7), чем пищевой TiO 29 (- 20 мВ при рН 7), что может быть связано с покрытием TiO 2 в составе жевательной резинки [26].
| Ссылка | [18] | [20] | [19] |
|---|---|---|---|
| Экспериментальные условия | 9025 Ультрафиолетовая вода 80260UltraPure , без фиксации ионной силы | KNO 3 10 -2 мол. л -1 | |
| IEP | 4,0 ≤ pH ≤ 4,2 | pH = 5.1 | 3.2 ≤ pH ≤ 4.0 |
| ζ при pH 7 | −42 до −50 мВ | −35 мВ | −42 до −50 мВ |
Таблица 1.
Iso точка (IEP) и дзета-потенциал при pH 7 различного пищевого TiO 2 (E171), диспергированного в воде, без какого-либо белка.
2.4.5. Агломерация
Состояние дисперсии частиц в водном растворе определяется химией поверхности оксида и зависит от состава дисперсионной среды (pH, ионная сила, природа электролита и присутствие белков).Традиционно измерения дзета-потенциала используются для оценки стабильности коллоидных дисперсий: чем выше абсолютное значение дзета-потенциала, тем стабильнее дисперсия. Вокруг IEP или когда ионная сила высока в растворе, система нестабильна и происходит агломерация частиц, что приводит к осаждению суспензии. Таким образом, важно учитывать агломерацию в экспериментальной среде, так как это может изменить размер частиц, которые позже будут «видны» организмом после приема внутрь.
В обычных условиях pH и ионной силы частицы TiO 2 имеют тенденцию образовывать агломераты крупных размеров (частицы относительно свободно связаны), которые оседают через несколько часов, частично из-за большой плотности TiO 2 (3,9 г). / см 3 для анатаза в виде порошка). При нейтральных значениях рН (около 6–7) и в отсутствие какой-либо соли частицы E171 представляют агломераты диаметром 200–400 нм, что согласуется с дзета-потенциалом, в основном отрицательно измеренным. Когда pH становится ближе к IEP, измеренный диаметр превышает 1 мкм, что является признаком агломерации из-за низких электростатических отталкиваний [18].
Как только частицы агломерированы или агрегированы, они не легко фрагментируются и их трудно диспергировать в виде первичных частиц. Ультразвуковая обработка ультразвуком может использоваться для разрушения агломератов до измерения дзета-потенциала и размера, при условии, что ультразвук не изменяет химический состав материала [32]. Гидродинамический диаметр частиц E171, диспергированных в сверхчистой воде (pH не указан) и обработанных ультразвуком в ванне (в течение 5–30 мин), составляет от 120 до 400 нм [19, 26]. Другая возможность стабилизировать суспензию и избежать агломерации частиц состоит в добавлении диспергатора, который способен покрывать частицы и создавать стерическое препятствие между ними [33].Бычий сывороточный альбумин (BSA) обычно использовали для стабилизации частиц E171 TiO 2 в сочетании с ультразвуковой обработкой ультразвуком (30 мин), что приводило к среднему гидродинамическому диаметру 150 нм [4]. В растворах с добавлением солей (NaCl и NaHCO 3 ) частицы E171, диспергированные ультразвуком, обладали умеренной стабильностью, при этом размер агломератов оставался между 360 и 390 нм в течение по меньшей мере 2 часов. Тот же эксперимент, проведенный с образцом P25, показал быструю и обширную агрегацию частиц [4].
2.4.6. Особенности пищевых порошков TiO 2
Пищевые порошки TiO 2 наконец характеризуются низкой удельной поверхностью (около 10 м 2 / г), чисто кристаллической фазой анатаза (иногда следами рутила) низкая изоэлектрическая точка (около 4,1 в воде), связанная с фосфатом, обнаруженным на его поверхности, средний размер 140 нм с распределением от 30 до 300 нм и доля наночастиц, составляющая от 17 до 36%. Для токсикологических исследований, включая оценку токсичности при пероральном воздействии, обычно используется другой вид TiO 2, называемый P25, поскольку он рассматривается в качестве справочного материала [34].Это соединение характеризуется 100% НЧ, средним размером 23 нм, удельной площадью поверхности 50 м 2 / г, смесью зерен анатаза и рутила (85/15) и изоэлектрической точкой при рН 6,5 [18 19]. На рисунке 3 представлены некоторые физические и химические свойства образцов E171 и P25, извлеченных из двух исследований [18, 19].
Рисунок 3.
Физико-химические параметры, описывающие формы TiO2 E71 и P25, а именно содержание в NP, изоэлектрическая точка (IEP), средний размер распределения, полученный с помощью просвечивающей электронной микроскопии (среднее значение S), и диапазон распределение частиц по размерам (диапазон).Данные взяты из ссылок [8, 19].
Образцы P25 четко отличаются от образцов E171 по всем принятым параметрам. Также наблюдается своеобразный образец E171, богатый рутильной фазой. E171 TiO 2 сильно отличается от эталонного материала P25, поэтому мы пришли к выводу, что P25, по-видимому, не является наиболее подходящим эталонным материалом для исследований токсичности при проглатывании [18]. Кроме того, это не самый важный материал для представления фракции наночастиц E171.
2.5. Судьба TiO 2 после приема внутрь
Среди различных путей воздействия TiO 2 путь перорального поглощения остается менее документированным. При попадании внутрь частицы TiO 2 проходят через пищеварительный тракт, начиная с порта входа, через полость рта и желудочно-кишечный тракт, включая пищевод, желудок, тонкий и толстый кишечник и прямую кишку (рис. 4).
Рисунок 4.
Схематическое изображение судьбы TiO2 в пищеварительном тракте, иллюстрирующее потенциальные механизмы, посредством которых проглатываемые наночастицы взаимодействуют с кишечным барьером; (1) слизь; (2) микробиота; (3–5) эпителий с (3) интернализацией и активным транспортом в лимфатические фолликулы Пейера с помощью М-клеток, (4) трансклеточным транспортом и (5) параклеточным транспортом через межклеточные плотные соединения (межклеточное пространство между адгезивными эпителиальными клетками).Неограниченная миграция через очаги поврежденного эпителия не представлена. Для ясности схема не в масштабе.
Во время транзита через пищеварительные жидкости частицы TiO 2 не метаболизировались и было обнаружено, что они в основном агломерированы, опосредованы белками и электролитами [35, 36], но, согласно некоторым исследованиям, небольшая доля все еще находится в наноразмерный диапазон [35, 37, 38]. Считалось, что низкая абсорбция TiO 2 и, наоборот, высокий процент диоксида титана, выделяемого из организма с фекалиями [39, 40], являются доказательством любого неблагоприятного воздействия.Однако последние данные о кишечном отделе ставят эту веру под сомнение. Действительно, кишечный барьер, который включает в себя эпителий, слизь и микробиоту на его просветной стороне (рис. 4), обеспечивает физическую, химическую и биологическую линию защиты для хозяина, вероятно, посредством оркестровки [41, 42]. Взятые вместе или независимо, эти три партнера демонстрируют некоторые изменения из-за присутствия частиц TiO 2, которые кратко сообщаются из микробиоты в эпителий.
2.5.1. TiO 2 во взаимодействии с кишечной микробиотой
Влияние TiO 2 на состав кишечной микробиоты и метаболическую активность на животных моделях или людях в основном неизвестно, тогда как кишечная микробиота активно способствует поддержанию гомеостаза хозяина. Действительно, он играет ключевую роль в кишечнике, выполняя функции защиты, созревания и производства. В частности, он действует как барьер против патогенов, предотвращая их имплантацию, и участвует в метаболизме ксенобиотиков [43].
Исследования, о которых сообщалось до настоящего времени, были в основном сфокусированы на антибактериальной активности наночастиц TiO 2 в чистых культурах in vitro с использованием Escherichia coli в качестве представителя бактерий [44–46]. Такая активность, как правило, связана с фотокаталитическими эффектами TiO 2 , хотя увеличение экспериментальных данных также продемонстрировало изменения клеток, опосредованные TiO 2 , без ультрафиолетового освещения [50, 51]. Тейлор и соавт. [47] исследовали воздействие in vitro на кишечное микробное сообщество здорового донора тремя различными типами наночастиц оксида металла, включая TiO 2, в модельной ободочной кишке.Такие вызванные воздействием изменения в фенотипических признаках кишечного сообщества, включая продуцирование короткоцепочечных жирных кислот (особенно для масляной кислоты), гидрофобность клеток, содержание сахара во внеклеточных полимерах, размер клеток и электрофоретическую подвижность. В дальнейшем исследовании Waller et al. [48] оценивали влияние пищевого TiO 2 (против промышленного TiO 2 ) на состав и фенотип микробиоты кишечника человека. Наблюдалось ингибирование индуцированного контролем изменения микробного состава от протеобактерий к типу Firmicutes.Воздействие TiO 2 также привело к более низкому значению рН толстой кишки (HpH 4) по сравнению с контролем (> 5). Кроме того, аналогичные тенденции в гидрофобности микробного сообщества и электрофоретической подвижности были получены между контролем и пищевым воздействием. Интересно, что различные микробные реакции наблюдались с формой промышленного уровня, лежащей в основе значения физических и химических свойств TiO 2 при кишечном гомеостазе.
2.5.2. TiO 2 во взаимодействии с кишечной слизью
Слизь - это вязкоупругий гель, который выравнивает и защищает кишечный эпителий.Он непрерывно секретируется по всему кишечнику специализированными кубковыми клетками в эпителии (рис. 4) и присутствует в больших количествах в толстой кишке, чем где-либо еще. Долгое время считалось, что слизь действует как «простой» физический барьер, но теперь известно, что она обладает другими ключевыми функциями, необходимыми для сохранения кишечного гомеостаза [49–51], включая (i) смазывание эпителия, облегчая прогрессирование материал вдоль пищеварительного тракта, (ii) поддержание стабильной микросреды на поверхности эпителия, (iii) защита эпителия посредством присутствия молекул иммунной системы и (iv) обеспечение экологической ниши для кишечной микробиоты.
Взаимодействие между TiO 2 и кишечной слизи далеко не поняты. Переменные емкости для поглощения и транспорта наночастиц TiO 2 были описаны in vitro [52], в зависимости от того, культивируются ли эпителиальные клетки отдельно или в присутствии слизисто-секретирующих бокаловидных клеток. Фактически, клетки Caco-2 в монокультуре демонстрировали только низкие уровни внутриклеточного накопления nano-TiO 2 после 24-часового воздействия, тогда как такая же обработка в совместной культуре, продуцирующей слизь Caco-2 / HT29-MTX, приводила к 50 раз более высокие уровни накопления [52].В исследованиях ex vivo на слизистой оболочке щеки свиньи [36, 38] наночастицы TiO 2, независимо от их размера и гидрофильности / гидрофобности, были способны проникать через слизь и проникать в нижележащие ткани.
2.5.3. TiO 2 во взаимодействии с кишечным эпителием
Эпителий отвечает за питательные вещества и абсорбцию воды, одновременно ограничивая доступ потенциально вредных веществ к внутренним органам. Таким образом, он представляет собой селективный и динамический барьер, опосредующий транспорт соединений через трансклеточный путь (т.е.через клетки) и / или параклеточный путь (т.е. между клетками). Он поляризован в апикальную и базолатеральную поверхность с апикальной поверхностью, покрытой микроворсинками, для увеличения площади абсорбирующей поверхности. Существует по крайней мере три пути, обеспечивающие поглощение / транслокацию наночастиц TiO 2 (рис. 4): во-первых, они могут разрушать клеточные соединения (параклеточный путь), во-вторых, они могут интернализироваться клетками (трансклеточный путь, например, эндоцитоз) и, наконец, они могут оказывать токсическое воздействие на клетки или изменять их функцию, что приводит к гибели клеток [53].Кроме того, во многих исследованиях подчеркивается участие богатого М-клетками слоя пластырей Пейера, которые представляют собой эпителиальные клетки, специализирующиеся на трансцитозе макромолекул и частиц [40, 53–56] (рис. 4). Однако этот механизм транслокации все еще обсуждается, поскольку противоречивые результаты были получены для клеток in vitro [36, 40, 53, 55–57].
Исследования in vitro , в основном на клетках Caco-2, сходятся на возможном разрушении эпителиального барьера, вызванном TiO 2 .Действительно, были отмечены едва заметные или более существенные изменения, в том числе цитотоксичность [58], изменение микроворсинок на границе кисти [26, 53], усиление регуляции переносчиков питательных веществ и оттока насосов [59], производство активных форм кислорода [59, 60]. дисбаланс систем окислительно-восстановительного восстановления [59], увеличение проницаемости эпителия [60] и поглощение / перемещение наночастиц TiO 2 [53, 55, 60], в разной степени в зависимости от типа наночастиц TiO 2 ( размер и кристаллическая фаза) и используемые экспериментальные условия.
В соответствии с выводами Faust et al. [26], недавние данные свидетельствуют о некоторых неблагоприятных эффектах перорального воздействия E171 на барьер слизистой оболочки кишечника с предполагаемым дополнительным воздействием на кишечные заболевания и колоректальный рак [61–63]. Proquin et al. [63] показали in vitro , что E171 индуцировал образование АФК и повреждение ДНК через его микроразмерные и / или наноразмерные фракции в клетках Caco-2 и HCT116. У грызунов Bettini et al. [61] обнаружили частицы TiO 2, присутствующие в пластырях Пейера вдоль тонкой кишки, а также в слизистой оболочке толстой кишки крыс, которым перорально вводили E171 на соответствующих человеческих уровнях.Никаких существенных изменений в эпителиальной параклеточной проницаемости не наблюдалось.
2.5.4. Биораспределение TiO 2
Когда частицы TiO 2 преодолевают слизь / микробиоту / эпителий-защитную триаду, они могут попадать в системное кровообращение [64, 65], но в крайне ограниченном количестве [36] и проникать в такие органы, как печень и почки, которые являются органами для метаболизма экзогенных химических веществ и для выведения отходов обмена веществ, соответственно. Но они также были обнаружены в легких, селезенке и мозге [66, 67] и имели плохой клиренс [67].Таким образом, при периоде полураспада 12,7 дня [66] частицы TiO 2 могут регулярно обновляться в организме, что предполагает биоаккумуляцию [23], но в условиях исследования отсутствуют токсикологические эффекты [66]. В терминальной подвздошной кишке детей, подозреваемых на воспалительные заболевания кишечника, количество пигмента в пятнах Пейера становилось более плотным с возрастом [68].
3. Заключение
В целях обеспечения здорового питания за последние 5 лет возросло знание о TiO 2 в качестве пищевой добавки.Среди большого набора образцов TiO 2 пищевые материалы E171 имеют физико-химические свойства, отличающиеся от эталонного материала P25. Действительно, он характеризуется низкой удельной поверхностью (около 10 м 2 / г), чистой кристаллической фазой анатаза (иногда следами рутила), низкой изоэлектрической точкой (около 4,1 в сверхчистой воде), в основном связанной с фосфатом обнаруженный на его поверхности, средний размер около 140 нм с распределением, охватывающим от 30 до 300 нм, и доля наночастиц, составляющая от 17 до 36%.Из-за отсутствия данных по E171 оценка риска перорального воздействия TiO 2 была в основном выполнена с наноматериалами TiO 29, такими как P25, которые обладают различной химией поверхности. Поскольку TiO 2 имеет низкую скорость абсорбции, он в основном выделяется с фекалиями, что свидетельствует о том, что он не представляет проблемы токсичности. Тем не менее, существует растущая осведомленность о доказанных или предполагаемых вредных эффектах TiO 2 во время его транзита в пищеварительном тракте путем нарушения гомеостаза кишечника перед абсорбцией в верхних отделах и / или по всему кишечнику непоглощенной фракцией.Хотя все чаще признаваемые в качестве ключевых игроков в здоровье кишечника, слизь и микробиота часто игнорируются в пищевой нанотоксикологии и теперь должны быть более глубоко исследованы. Необходимо также подтвердить связь с некоторыми кишечными заболеваниями. Для всех дальнейших исследований использование пищевых форм TiO 2 более актуально, чем использование наноматериала P25.
1) В лакокрасочной промышленности он используется в качестве белого пигмента и глазури фарфора.
2) Может также использоваться в качестве покрытия и наполнения в бумажной промышленности, чтобы бумага была пригодной для печати и непрозрачной.
3) В металлургической промышленности его можно использовать для изготовления губчатого титана, сплава титана и
железа и твердого сплава и т. Д.
4 Также его можно использовать для изготовления непроводниковых, электрических сварочных стержней и фарфоровой эмали.
5) Может также использоваться в синтетическом волокне, пластике, резине, печати, краске, косметике.
Упаковка: 20 кг / бочка или в соответствии с вашими требованиями
Фотографии нашего пищевого сорта диоксида титана
О нашей компании
Jiang2 Since С 16
Since С Лтд занимается производством пигментов на основе наночастиц диоксида титана (TIO2), основного в мире пигмента для обеспечения белизны, яркости и непрозрачности.
TG Chemical с самых ранних времен и до наших дней продолжает лидировать в отрасли как в области технологических инноваций, так и качества продукции.
.

