В каких продуктах есть бром
Бром (Br) в продуктах питания и его роль в организме человека
Как и другие микроэлементы, бром является важным компонентом для здорового функционирования организма человека. Как нехватка, так и избыток брома может спровоцировать серьезные проблемы.
Общая характеристика
Бром распространен в природе очень широко. Особенно много его в соленой воде, есть он также в растениях и горных породах. В чистом виде он представляет собой густую едкую жидкость темно-красного цвета с очень неприятным запахом.
Открыт микроэлемент был в первой половине 19 столетия, и одновременно его представили миру два ученых – французский химик Антуан Жером Балар и немец Карл Якоб Лёвих. Причем первый сначала назвал элемент муридом (в переводе – рассол), поскольку открыл он его при изучении соляных промыслов Средиземного моря.
Биологическая роль брома в организме человека
В организме взрослого здорового человека находится около 200-300 мкг брома. Его содержат почки, гипофиз, щитовидная железа, ткани мышц и костей, а также кровь. Микроэлемент принимает активное участие в таких процессах организма:
- активизирует пепсин;
- активизирует определенные ферменты, такие как липазы и амилазы;
- оказывает влияние на щитовидную железу;
- принимает участие в регуляции нервной системы;
- активизирует половые функции.
Биологическая роль брома в организме была доказана далеко не сразу. В наше время известно, что он способствует регуляции процессов торможения и возбуждения нервной системы, в основном, в коре головного мозга, и обеспечивает правильный баланс. Ввиду этого он часто является компонентом успокаивающих средств. Поскольку бром – антагонист йода, он предотвращает гиперфункцию щитовидной железы, а также активизирует работу надпочечников. Принимает активное участие в обмене жиров и углеводов. Также существует предположение, что данный микроэлемент нужен для кроветворения.
Суточная потребность
Норма потребления брома в сутки для среднестатистического взрослого человека составляет 3-8 мг.
Полезные свойства брома
В виде бромидов микроэлемент используют для лечения различных заболеваний. Он обладает высоким седативным действием, ввиду чего препараты брома нередко показаны при нервных нарушениях и проблемах со сном. Соли брома эффективно используются для борьбы с болезнями, причиняющими судороги, а также при проблемах в работе сердечно-сосудистой системы, болезнях желудка и кишечника, в частности, язвенных заболеваний.
Для избавления от каловых камней, при употреблении «вредной пищи», применяется очистительная клизма. Читайте всё об очистительной клизме в домашних условиях — правила постановки и противопоказания, отзывы об использовании.
Узнайте, чем полезен гранат для вашего организма. Лечебные свойства гранатового сока и его кожуры.
Симптомы недостатка брома в организме
Нехватка брома в организме человека возможна в том случае, если он употребляет в пищу мало растительных продуктов, а также ввиду проживания в местностях, где содержание микроэлемента в окружающей среде низкое. Это горные области и регионы, далекие от моря. Симптомы недостатка бора в организме следующие:
- высокая раздражительность, склонность к истерикам;
- низкая половая активность;
- проблемы со сном, бессонница;
- замедленный рост у детей;
- пониженный уровень гемоглобина в крови;
- пониженная кислотность желудочного сока.
Недостаток брома в организме может стать причиной уменьшения длительности жизни, а также повышения рисков выкидыша при беременности. При постоянных симптомах недомогания не медлите с обращением к врачу.
Признаки избытка
Избыток брома обычно проявляется при передозировке препаратов, его содержащих, что крайне нежелательно. Среди признаков избытка брома:
- появление на коже воспалений и высыпаний;
- подавленность и общая слабость;
- проблемы в работе органов пищеварения;
- регулярный насморк и кашель, которые не имеют отношения к простуде и вирусам.
Соединения брома являются малотоксичными, в то время как элементарный бром – сильнейший яд. Даже незначительное превышение содержания брома в окружающей среде может стать причиной постоянных головокружений, раздражений слизистых дыхательных органов и глазных оболочек, кровотечений из носа. Если концентрации брома значительно выше нормы, возможны спазмы дыхательных путей и даже летальный исход из-за удушья. Смертельная доза для человека – 3 г брома.
Если бром попадает на кожу, может возникнуть очень сильный ожог. Регулярные отравления малыми дозами могут спровоцировать проблемы со сном и памятью, ухудшение пищеварения. В случае отравления бромом нужно как можно раньше вывести человека на воздух. При удушье можно использовать вату, смоченную в нашатыре. Дальше лечение должен осуществлять врач.
Бром в продуктах питания
Большую часть брома организм получает с продуктами питания. В связанном виде, будучи частью солей либо органических кислот, он является малотоксичным. Бром содержат бобовые, особенно фасоль, горох и чечевица, орехи, зерновые. Именно растительные продукты считаются главными его источниками. Содержится и в морепродуктах, и в морской рыбе. Есть он в поваренной каменной соли. Организм довольно хорошо усваивает данный микроэлемент, но происходит это только при наличии других компонентов, таких как фтор, йод, алюминий и хлор.
Таблица содержания брома в продуктах
| Продукт | Содержание брома на 100 г продукта |
|---|---|
| Морская капуста | 250 мкг |
| Креветки | 230 мкг |
| Треска | 230 мкг |
| Пшеница | 80 мкг |
| Ячневая крупа | 70 мкг |
| Горох | 40 мкг |
| Фасоль | 40 мкг |
| Чечевица | 40 мкг |
| Грецкие орехи | 60 мкг |
| Арахис | 60 мкг |
| Миндаль | 60 мкг |
| Фундук | 60 мкг |
| Кешью | 60 мкг |
| Нут (турецкий орех) | 40 мкг |
| Макаронные изделия | 40 мкг |
| Молоко | 30 мкг |
| Кисломолочные продукты | 20 мкг |
| Твердый сыр | 20 мкг |
| Хлеб | 40 мкг |
| Поваренная соль | 3 мкг |
применений брома - наука поражена
Хотя это не очень хорошо известно, бром используется в различных отраслях промышленности. Вот дополнительная информация о приложениях и использовании брома.
В периодической таблице группа элементов называется галогеном. Эта группа содержит йод, фтор, хлор и астат вместе с бромом. Атомный номер брома 35, а его атомный вес 79,90 а.е.м. Это уникальный элемент в периодической таблице в том смысле, что это единственный неметаллический элемент, находящийся в жидкой форме при комнатной температуре.Известно, что бром вреден для человека, поскольку он может поражать глаза, кожу и дыхательные пути и требует тщательного обращения.
Применение брома
Хотите написать для нас? Что ж, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим ...
Давайте работать вместе!
В жидкой форме бром имеет красновато-коричневый цвет. Его пары имеют резкий запах и красноватый цвет. Было обнаружено, что бром более растворим в сероуглероде и таких растворителях, как метанол и уксусная кислота, чем в воде.Ему нужен только один электрон, чтобы заполнить октет электрона во внешней оболочке. Это позволяет ему принимать участие в различных химических реакциях и действовать как сильный окислитель.
В огнестойких химикатах
Одно из важных применений брома - производство бромированных антипиренов. Они используются в качестве химических антипиренов в пластмассовой промышленности и в таких продуктах, как кабели, соединители, пластиковые крышки. Огнестойкость брома также используется для обеспечения безопасности таких продуктов, как ковры, обивка, краски и кухонные приборы.Он также используется в швейной и мебельной промышленности, чтобы предотвратить возгорание продуктов. В электронной промышленности, особенно в компьютерах, он используется для изготовления огнестойких печатных плат. Полибромированный дифениловый эфир, полибромированный дифенил, декабромдифениловый эфир, гексабромциклододекан, тетрабромбисфенол - вот лишь несколько примеров антипиренов, которые производятся с использованием брома.
Как дезинфицирующее средство
Бром - это отбеливающее средство, которое используется для дезинфекции воды в градирнях и плавательных бассейнах.В этом случае тест-полоски на бром используются для определения фенолов и соединений с ненасыщенными двойными связями, а также щелочности, pH и жесткости воды. В больницах, коммерческих предприятиях и домах он чаще всего используется в качестве дезинфицирующего и бактерицидного средства для нейтрализации бактерий, водорослей и грибков. Он также используется в качестве дезинфицирующего средства в местах, где вероятность контакта с пищевыми продуктами меньше или вовсе отсутствует. Бром также предпочтителен для дезинфекции промышленной воды.
Соединения для очистки воды
Бром можно найти в продуктах, которые используются в системах очистки воды.Тралометрин - один из таких продуктов, используемых для очистки питьевой воды. Количество брома в воде не должно превышать 100 мг / децилитр, что является самым низким уровнем токсичности. Если бром обнаружен в количествах выше указанных, он может оказаться вредным.
В пестицидах
Бром также используется в сельскохозяйственных продуктах, таких как пестициды, для уничтожения вредителей. Наиболее предпочтительно избавляться от вредителей, поражающих сельскохозяйственные культуры, такие как картофель, помидоры и т. Д. Бромистый метил - это химическое соединение, которое действует как фумигат.Он используется для защиты хранимого зерна и других продуктов путем уничтожения вредителей.
В фотопленке
Наиболее известное применение брома - изготовление фотопленок. Бромид серебра светочувствителен и используется для изготовления фотопластинок. Его микроскопические частицы под воздействием света претерпевают изменения в результате химической реакции. Это свойство бромистого серебра отвечает за создание изображения, когда фотопленка подвергается воздействию света при щелчке спуска затвора.Бромид калия используется в фотографии, чтобы предотвратить нежелательное восстановление серебра, которое вызывает запотевание фотографии.
В медицине
Бром использовался в качестве лекарственного средства в той или иной форме в течение длительного времени. В первую очередь, полученные из него химические соединения используются как пероральные седативные средства, для лечения эпилепсии и как мочегонные средства. Он хорошо известен своей депрессивной ролью центральной нервной системы при отравлении бромидом. В прошлом, еще в начале 20 века, бромид калия использовался в качестве предпочтительного седативного средства.Bromo-Seltzer - еще один продукт, который использовался до 1975 года, прежде чем он был прекращен FDA.
В красителях
Это было в 1909 году, когда немецкий химик Пауль Фридлендер обнаружил, что тирский пурпурный краситель (от красно-фиолетового до темно-фиолетового) содержит бром. В таком виде он был известен человеку сотни лет. Тирийский пурпурный краситель - это не что иное, как химический 6,6'-диброминдиго. Другой такой используемый краситель - это бромид тетрабутиламмония. Есть много других применений в текстильной промышленности.
Другое применение
- Соли брома, образованные с кальцием, натрием и цинком, растворимы в воде.Образованный таким образом плотный раствор используется в качестве бурового раствора при бурении скважин.
- Бромид этидия или EtBr используется в качестве красителя ДНК в процессе гель-электрофореза. Обычно это химическое вещество в ультрафиолетовом свете излучает оранжевое свечение, которое усиливается, если EtBr связывается с ДНК.
- Бром используется для уменьшения загрязнения ртутью, вызываемого угольными электростанциями. Активированный уголь и уголь, обработанный бромом, делают свое дело.
- 5-бромурацил используется в качестве искусственного мутагена, который помогает ученым заставить изменяться генетический материал, такой как ДНК.
Внимание !!!
Хотите написать для нас? Что ж, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим ...
Давайте работать вместе!
Хотя известно, что бром не причиняет вреда сразу же при контакте, продолжительное воздействие может привести к дисфункции щитовидной железы. Это может снизить уровень йода в организме, подвергая человека риску рака. Людям с нарушением функции щитовидной железы следует выбирать экологически чистые продукты, поскольку многие из них содержат соединения брома.То же самое и с водой, поскольку часто ее обрабатывают бромом. Лучше избегать хлебобулочных изделий, зубной пасты с броматом калия, а также цитрусовых напитков, содержащих бромированные растительные масла. Также полезно знать огнестойкие химические вещества, используемые в таких предметах, как компьютеры, пластмассы, ковры, автомобили и т. Д. Проверьте этикетку на медицинских продуктах, таких как назальные спреи и ингаляторы, чтобы знать, что они не содержат брома.
Бром - очень полезный элемент, как видно из его применений, представленных выше.Вы можете найти его в основной промышленности, такой как сельское хозяйство, или в продуктах, которые используются для отдыха, например в фотографии. В таких отраслях, как фармацевтика и крашение, также используются химические вещества, полученные из брома.
. БромПри температуре окружающей среды бром представляет собой коричневато-красную жидкость. Он имеет пар аналогичного цвета с неприятным удушающим запахом. Это единственный неметаллический элемент, который в обычных условиях является жидким, он легко испаряется при стандартной температуре и давлении в виде красного пара, который имеет сильный неприятный запах, напоминающий запах хлора. Бром химически менее активен, чем хлор и фтор, но более активен, чем йод; его соединения аналогичны соединениям других галогенов.Бром растворим в органических растворителях и в воде. ПримененияБром используется в промышленности для производства броморганических соединений. Основным из них был дибромэтан, агент для этилированного бензина, до того, как они были в значительной степени прекращены из-за экологических соображений. Другие броморганические соединения используются в качестве инсектицидов, в огнетушителях и в фармацевтических препаратах. Бром используется в производстве фумигантов, красителей, огнезащитных средств, составов для очистки воды, дезинфицирующих средств, лекарственных средств, средств для фотографии и в бромированных растительных маслах, используемых в качестве эмульгатора во многих растворимых напитках со вкусом цитрусовых. Бром в окружающей средеБром - это природный элемент, который можно найти во многих неорганических веществах. Однако люди много лет назад начали внедрение органического брома в окружающую среду. Все эти соединения не являются естественными и могут нанести серьезный вред здоровью человека и окружающей среде. В диффузных породах земной коры бром естественным образом встречается в виде бромидных солей. В морской воде накопились соли брома (85 частей на миллион), из которых бром извлекается.
Вернуться к таблице Менделеева . |
|
Простая английская Википедия, бесплатная энциклопедия
Пробирка с бромом в ней. Внизу находится бром в виде жидкости, а над ним - бром в виде газа. Трубка запаяна в акриловый куб.Бром (Br) - химический элемент. Его атомный номер (то есть количество протонов в нем) - 35, а его атомный вес - 80. Он является частью элементов группы 7 (галогенов) периодической таблицы. Он двухатомный, что означает, что два атома слипаются, образуя молекулу в любом образце брома.
Физические свойства [изменить | изменить источник]
Бром - жидкость красно-коричневого цвета. Жидкие элементы встречаются редко; только бром и ртуть являются жидкими при комнатной температуре. Он легко испаряется, образуя удушающие коричневые пары. Имеет неприятный запах. Его название означает «зловоние козлов». Он может превратиться в металл при очень высоких давлениях.
Имеет два стабильных изотопа. Это 79 руб. И 81 руб. Есть около 29 других радиоактивных изотопов.
Химические свойства [изменить | изменить источник]
Бром довольно реакционноспособен.Его реакционная способность находится между хлором, который более реакционноспособен, и йодом, который реакционноспособен меньше. Реагирует с металлами и неметаллами. Фосфор бурно реагирует с бромом. Аналогично реагирует и алюминий. Он может отбеливать такие вещи, как хлор. Лучше реагирует на свет. Немного растворяется в воде. Горячая вода делает ее непропорциональной на бромистоводородную и бромистоводородную кислоты. Бром может образовывать соединения с такими веществами, как натрий, с образованием бромида натрия.
Химические соединения [изменить | изменить источник]
Бром образует соединения во многих степенях окисления: –1, +1, +3, +5 и (иногда) +7.–1 - самый распространенный. Встречается в виде бромида. Бромиды не реагируют. Это бесцветные твердые вещества, легко растворяющиеся в воде. Ковалентные бромиды могут быть жидкостями или газами. Все остальные соединения являются сильными окислителями. Их хлорные собратья встречаются чаще. +1 имеет гипобромиты, которые нестабильны. +3 имеет бромиты. Диоксид брома - единственное распространенное соединение брома, обнаруженное в степени окисления +4. +5 имеет броматы, которые встречаются чаще, чем все остальные, кроме бромидов.Броматы - сильные окислители, иногда их добавляют в муку. +7 имеет перброматы. Перброматы очень нестабильны.
Бром находится в виде бромида в океане и в бассейнах с рассолом. В Мертвом море много бромида. Бром не является важной частью нашего тела, в отличие от его родственников хлора и йода.
Бром получают барботированием газообразного хлора через раствор бромида.Бромид окисляется до брома, а хлор восстанавливается до хлорида.
В основном используется для получения броморганических соединений, органических соединений с бромом. Броморганические соединения используются для тушения пожаров. Раньше их добавляли в бензин. Некоторые использовались как пестициды. Некоторые неорганические бромиды использовались в качестве седативных средств. Бром также можно использовать в качестве дезинфицирующего средства. Бромид серебра используется в пленке.
Бром токсичен и вызывает коррозию кожи. Газообразный бром также вызывает раздражение при вдыхании.Бром может бурно реагировать со многими вещами.
.Фактов о броме, Символ, Открытие, Свойства, Использование
Что такое бром
Бром (произносится как BRO-meen) - это летучий маслянистый жидкий галоген с промежуточной реакционной способностью между хлором и йодом. Двухатомный элемент обозначается химическим символом Br [2] . В газообразном состоянии, также называемом газообразным бромом, он представлен химической формулой Br2 [1].

Символ брома
Изотопы
Он содержит 26 изотопов с массовыми числами от 68 до 94, из которых только Br-79 и Br-81 являются наиболее часто встречающимися изотопами, имеющими стабильный период полураспада. [3] .
Где находится бром
Br существует в естественных условиях в месторождениях рассола в Израиле, США и Китае, откуда его извлекают путем электролиза. Он также встречается в морской воде, обычно в богатом бромидом Мертвом море недалеко от Израиля [1].

Бром
История
Происхождение названия: Название произошло от греческого слова «бромос», что означает зловоние [1] .
Кто это открыл: Антуан-Жером Балар и Карл Ловиг
Когда и где был обнаружен бром
Выпаривая образец соленой воды из Монпелье, Франция, он обнаружил остаток, через который прошел газообразный хлор.В этом процессе он извлек оранжево-красную жидкость, которая считалась новым элементом. В 1826 году подробности его открытия были отправлены в журнал Французской академии. Однако год назад студент из Гейдельберга по имени Карл Лоуиг извлек тот же элемент из воды естественного источника в Керуцнахе, своем родном городе. Он показал это своему профессору Леопольду Гмелину, который попросил его произвести больше, но, поскольку первый был занят экзаменами, Балард опубликовал свои результаты и стал первооткрывателем [1, 2] .
Изображения брома
Идентификационный номер | |||
| Атомный номер | 35 [1] | ||
| Номер CAS | 7726-95-6 [1] | ||
| Позиция в таблице Менделеева [1] | Группа | Период | Блок |
| 17 | 4 | п. | |
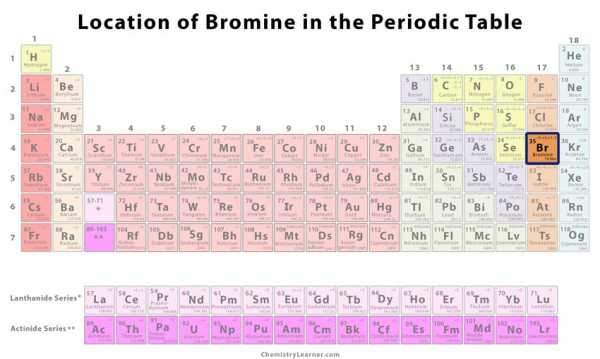
Классификация, свойства и характеристики брома
Общая недвижимость | |||
| Относительная атомная масса | 79.904 [1] | ||
| Атомная масса / вес | 79,904 атомных единиц массы [7] | ||
| Молярная масса (молекулярная масса) | 192,217 г / моль [3, 8] | ||
| Массовое число | 80 | ||
Физические свойства | |||
| Цвет / внешний вид | Темно-красный [1] | ||
| Запах | Сильный | ||
| Точка плавления / замерзания | -7.2 ° C (19 ° F) [1] | ||
| Температура кипения | 58,8 ° C (137,8 ° F) [1] | ||
| Плотность | 3,1028 г / см 3 [1] | ||
| Стандартное / естественное состояние при комнатной температуре (твердое тело / жидкость / газ) | Жидкость [1] | ||
Магнитные свойства [9] | |||
| Магнитный тип | Диамагнитный | ||
| Молярная магнитная восприимчивость | -7.83 × 10 -10 м 3 / моль | ||
| Массовая магнитная восприимчивость | -4,9 × 10 -9 м 3 / кг | ||
| Объемная магнитная восприимчивость | -0,0000153 | ||
Химические свойства | |||
| Воспламеняемость | Невоспламеняющийся [10] | ||
| Степени окисления (числа) | 6, 4, 3, 2, 1,0, -1 [1] | ||

Точечная структура брома Льюиса (электронная)
Атомные данные брома (элемент 35)
| Валентные электроны | 7 [12] | ||||||
| Квантовые числа [11] | |||||||
| - н. | 4 | ||||||
| - | 1 | ||||||
| - м ℓ | 0 | ||||||
| - м с | -1/2 | ||||||
| Электронная конфигурация (конфигурация благородного газа) | [Ar] 3d 10 4s 2 4p 5 [1] | ||||||
| Атомная структура [8] | |||||||
| - Количество электронов | 35 | ||||||
| - Количество нейтронов | 45 | ||||||
| - Количество протонов | 35 | ||||||
| Радиус атома | |||||||
| - Атомный радиус | 1.85 Å [1] | ||||||
| - Электроотрицательность | 2,96 [13] | ||||||
| - Ковалентный радиус | 1,17 Å [1] | ||||||
| Энергия ионизации [1] (кДжмоль -1 ) | 1-й | 2-я | 3-й | 4-я | 5-й | 6-й | 7-й |
| 1139.859 | 2083.215 | 3473 | 4563,8 | 5760,2 | 8548,6 | 9938 | |
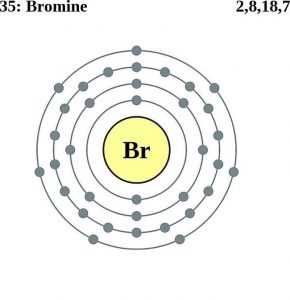
Атомная структура брома (модель Бора)
Что такое бром для
- Элемент используется в красителях, сельскохозяйственных продуктах, дезинфицирующих средствах для воды, инсектицидах, химических полупродуктах и фармацевтических препаратах [1, 10] .
- Используется в качестве пищевой добавки в бромированных растительных маслах, а также в качестве эмульгатора в холодных напитках [10] .
- Некоторые органические соединения, содержащие бромид и углерод, используются в галоновых огнетушителях [1] .
- Цинк-бромные батареи были полезны для электроснабжения отдаленных районов [14] .
Содержит ли элемент какие-либо токсические вещества
Случайное употребление жидкого галогена или его соединений может вызвать тошноту и рвоту, а вдыхание газа Br может вызвать респираторный дистресс, головную боль и головокружение. Известно, что контакт кожи с его паром или жидкостью вызывает раздражение и ожоги [6] .Фактически, его присутствие в виде бромата калия в пшеничной муке, используемой для приготовления хлеба, было связано с серьезными рисками для здоровья.
Интересные факты
- 1,2-дибромэтан, полученный из брома, использовался в качестве добавки к бензину до начала использования неэтилированного топлива [1] .
- Дорогой краситель под названием тирский пурпур, использовавшийся в древнеримский период, был произведен из соединения брома, обнаруженного в мурексе, морской мидии [2] .
- Бром тяжелее воздуха [6] .
Стоимость брома
Цена жидкого чистого брома может варьироваться от 5 до 6 долларов за 100 граммов.
Список литературы
- http://www.rsc.org/periodic-table/element/35/bromine
- https://education.jlab.org/itselemental/ele035.html
- https://education.jlab.org/itselemental/iso035.html
- https://pubchem.ncbi.nlm.nih.gov/compound/Dibromine#section=Computed-Properties
- https://www.chemicool.com/elements/bromine.html
- https://emergency.cdc.gov/agent/bromine/basics/facts.asp
- https://hobart.k12.in.us/ksms/PeriodicTable/bromine.htm
- https://www.convertunits.com/molarmass/Bromine
- http://periodictable.com/Elements/035/data.html
- https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/316642/Bromine_guidance.pdf
- http://chemistry-reference.com/q_elements.asp?Symbol=Br&language=en
- https: // bromine2015.weebly.com/
- https://sciencenotes.org/list-of-electronegativity-values-of-the-elements/
- https://www.sciencedirect.com/science/article/pii/0378775391800597









