В каких продуктах азот
где его больше всего, список продуктов питания, богатых данным элементом
Азот входит в состав земной атмосферы в молекулярном виде, на него приходится 76% атмосферы по массе.
В связанном состоянии элемент встречается в почве и воде в виде химических соединений.
В живых организмах (растениях и животных) азот представлен в составе органических соединений, входит в аминокислоты в количестве от 15% до 18%.
к оглавлению ↑Как влияет на организм
В начале 20 века было установлено, что для обеспечения жизнедеятельности живых организмов необходимо регулярное поступление в них некоторых химических соединений, включая азот.

В теле мужчины содержится в среднем 1,8 кг элемента, а женщины – 1,3 кг. Такая разница обусловлена тем, что белки входят в состав мышечной ткани, а у мужчин мышцы развиты сильнее, чем у женщин.
Для человека атмосферный азот является биологически неактивным веществом, поступающим в легкие с вдыхаемым воздухом и выводимым с выдыхаемым.
Потребность человека в белке складывается из 2 компонентов – удовлетворение потребности в общем азоте и в незаменимых аминокислотах.
Белковые соединения для синтеза своих тканей человек получает из пищи, которая должна содержать достаточное их количество.
Из необходимых организму аминокислот некоторые (называемые заменимыми) синтезируются в организме из аммиака и иных веществ, а несинтезируемые (называемые незаменимыми) должны поступать с пищей (растительной и животной).
Чтобы атмосферный азот оказался в составе белков, он должен претерпеть ряд превращений. Использовать его напрямую способны лишь живущие в почве бактерии рода Азотобактер с дальнейшим синтезом органических азотистых соединений.
Все остальные живые организмы не способны использовать атмосферный азот. У них азотистый обмен начинается с использования аммиака или аминокислот.
Аммиак образуют высшие растения путем восстановления содержащихся в почве нитратов с конечным биосинтезом аминокислот и белков.
Травоядные животные питаются растениями и превращают аминокислоты растений в собственные белки. Человек потребляет растительные и животные продукты и также превращает их в собственные ткани.
После смерти живых организмов микроорганизмы расщепляют органические вещества, азот поступает в почву, где ассимилируется азотфиксирующими бактериями и вновь превращается в органические вещества. Это и есть кругооборот азота в природе.
к оглавлению ↑Потребность человека в белке, симптомы дефицита
В конце 19 века было окончательно установлено, что при нормальных условиях организм человека находится в состоянии азотистого равновесия, т. е. поступление азота с пищей равняется количеству элемента в выделяемых с мочой азотистых веществах (мочевине).

Количество выделяемой взрослым человеком мочевины зависит от количества потребляемой белковой пищи и обычно составляет 25-35 г в сутки.
Азотистый баланс нарушается при голодании или недостатке в пище белков. Длительное состояние отрицательного азотистого баланса (когда азота выводится больше, чем поступает) ведет к гибели организма.
Положительный азотистый баланс наблюдается в период восстановления после голодания или истощения. Нормальным является положительный азотистый баланс у растущих детей и подростков до периода прекращения их роста.
Для поддержания азотистого равновесия человеку, по нормам Всемирной организации здравоохранения, достаточно потреблять ежесуточно 0,8 г полноценного по аминокислотному составу белка на каждый килограмм своего веса.
При смешанном растительно-животном питании потребность в связи со снижением усвояемости возрастает и доходит до 1,0 г/кг. Под весом при данном расчете понимается нормальный (идеальный) вес без учета избыточной жировой ткани, например, по формуле «Рост минус 105».
При перечисленных ниже состояниях потребность в белке (и в азоте) увеличивается:
- стрессы;
- заболевания и травмы;
- после хирургических операций;
- беременность;
- грудное вскармливание;
- интенсивная физическая нагрузка.

При избыточном весе и похудении на сниженном по калорийности рационе также необходимо увеличить норму белка до 1,2-1,3 г/кг.
Но здесь нужна мера – потребление белка в количестве свыше 1,5 г/кг нежелательно, а свыше 2 г/кг — вредно.
Рекомендации по потреблению больших доз отдельных аминокислот или их комбинаций в виде добавки для спортсменов силовых видов спорта и бодибилдеров не подтверждаются, а применение чистых аминокислот считается неблагоприятным для здоровья, тем более, если они поступают взамен белковой пищи.
В чистом виде белковая недостаточность встречается редко. Это следствие общего недоедания, т. е. недостаточности калорийности рациона. Состояние при одновременном глубоком дефиците белка и энергии называется маразмом.
К социальным причинам недостаточности питания относятся:
- стихийные бедствия;
- войны;
- терроризм.
Поражает белково-энергетическая недостаточность беднейшие слои населения.
В развитых странах белково-калорийная недостаточность может наступать, как следствие заболеваний, хронического алкоголизма и наркомании, со снижением потребления пищи и нарушением ее усвоения.
Симптомы белково-калорийной недостаточности:
- задержка роста детей;
- слабость и потеря мышечной массы, что ведет к снижению веса тела;
- развитие обширных отеков;
- сухость и шелушение кожных покровов;
- образование медленно заживающих гноящихся язв;
- выпадение и обесцвечивание волос;
- потеря аппетита, тошнота;
- рвота с последующим обезвоживанием;
- анемия;
- снижение иммунитета.

Где его содержание больше всего, рекомендации по употреблению
Наиболее полноценные по аминокислотному составу белки содержатся в животных продуктах – мясе, рыбе, молочных продуктах, яйцах.
Достаточно белка и в крупах, макаронных изделиях, хлебе, бобовых (сое, чечевице, фасоли, бобах), в орехах и семечках.
Ниже в таблице приведена информация о том, в чем (в каких продуктах питания) содержится белок (азот).
| Продукт | Содержание белка, г/100 г продукта |
| Говядина | 20-22 |
| Свинина | 14-19 |
| Яйца | 12,7 |
| Колбасы, сосиски, сардельки | 9-14 |
| Рыба | 13-23 |
| Молоко и кисломолочные продукты | 2,6-4,3 |
| Творог | 14-18 |
| Сыр | 23-31 |
| Крупы | 7-13 |
| Хлеб | 5-8 |
| Бобовые | 22-23 |
| Овощи | 0,6-4 |
| Картофель | 2 |
| Фрукты | 0,2-2 |
| Орехи | 12-25 |
Еще больше информации о продуктах, богатых белком (азотом) в этом видео:
к оглавлению ↑Допустимо ли сочетать белковые продукты с углеводными
Следующий из системы раздельного питания запрет на совместное употребление белковых и углеводных продуктов теорией рационального питания не обосновывается, да и эволюционно человек приспособлен к потреблению смешанной пищи.
Для полноценного усвоения белка необходимо оптимальное соотношение в нем аминокислот; этому условию отвечает смешанное растительно-животное питание.
Соблюдая рекомендации по разнообразному питанию и нормам потребления белка, удается обеспечить организм достаточным количеством белка и аминокислот без приема пищевых добавок.
к оглавлению ↑Дополнительные рекомендации и советы
Помимо белков, азот включен и в состав азотсодержащих экстрактивных веществ и пуриновых оснований.

Содержащие азот экстрактивные вещества возбуждают железы желудка и способствуют лучшему усвоению белков и жиров в продуктах питания и еде.
Однако эти вещества оказывают и неблагоприятное воздействие на нервную систему, что осложняет течение болезней органов кровообращения, желудочно-кишечного тракта, почек и нервной системы.
Поэтому из диетического питания исключаются первые блюда на мясных и рыбных бульонах, жареные или тушеные вторые блюда.
Пуриновые основания нарушают обменные процессы в организме, что приводит к задержке мочевой кислоты и отложениям ее солей в тканях — основно
Фактов об азоте, Символ, Открытие, Свойства, Использование
Что такое азот
Азот (произносится как Nye-treh-gen) - химический элемент, существующий в форме бесцветного двухатомного газа. Обозначается химическим символом N, он принадлежит к семейству неметаллов. Это пятый по содержанию элемент в земной коре, представленный молекулярной формулой N 2 [1, 2] . Существует 12 изотопов азота с массами от 11 до 19, из которых только N-14 и N-15 встречаются в природе [3] .

Обозначение азота
Где находится азот
В земной атмосфере он составляет около 78% воздуха, который оценивается примерно в 4000 триллионов тонн. Извлекается из сжиженного воздуха фракционной перегонкой [1, 2] .
История
Происхождение названия: Оно происходит от греческих слов «нитрон» и «гены», которые означают образование нитра. [1] .
Кто открыл это: Дэниел Резерфорд [1]
Когда, где и как было обнаружено
Впервые он был получен в 1760-х годах двумя английскими учеными Генри Кавендишем и Джозефом Пристли при попытке отделить кислород от воздуха.Однако им не удалось подтвердить наличие нового газообразного элемента в атмосфере. Только в сентябре 1772 года в Эдинбурге, Шотландия, Резерфорд назвал его азотом после тщательного анализа [1] .
Азот
Идентификационный номер | |||
| Атомный номер | 7 [1] | ||
| Номер CAS | 7727-37-9 [1] | ||
| Позиция в таблице Менделеева [1] | Группа | Период | Блок |
| 15 | 2 | с. | |
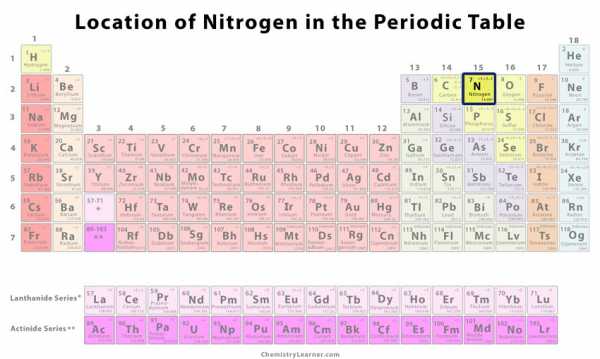
Расположение азота в Периодической таблице
Классификация, свойства и характеристики азота
Общие свойства | ||
| Относительная / средняя атомная масса | 14.007 [1] | |
| Атомная масса / вес | 14.007 атомных единиц массы [5] | |
| Молярная масса / молекулярный вес | 28,014 г / моль [4] | |
| Массовое число | 14 | |
Физические свойства | ||
| Цвет / внешний вид | Бесцветный [1] | |
| Запах | Без запаха [4] | |
| Точка плавления / замерзания | -210 ° C (-346 ° F) [1] | |
| Температура кипения | -195.795 ° C (-320,431 ° F) [1] | |
| Плотность | 0,001145 г / см 3 [1] | |
| Стандартное / Физическое состояние вещества при нормальной комнатной температуре (твердое тело / жидкость / газ) | Газ [1] | |
| Электропроводность | Неизвестно [3] | |
| Теплопроводность | 0,02583 Wm -1 K -1 [4] | |
Химические свойства | ||
| Воспламеняемость | Невоспламеняющийся [4] | |
| Степени окисления (числа) | 5, 4, 3, 2, -3 [1] | |

Точечная структура азота по Льюису
Атомные данные азота (элемент 14)
| Валентные электроны | 5 [6] | ||||||
| Электронная конфигурация (конфигурация благородного газа) | [He] 2s 2 2p 3 [1] | ||||||
| Атомная структура [3] | |||||||
| - Количество электронов | 7 | ||||||
| - Количество нейтронов | 7 | ||||||
| - Число протонов | 7 | ||||||
| Радиус атома | |||||||
| - Атомный радиус | 1.55 Å [1] | ||||||
| - Ковалентный радиус | 0,71 Å [1] | ||||||
| Электроотрицательность | 3,04 [3] | ||||||
| Заряд ионов | -3 [7] | ||||||
| Энергия ионизации [1] (кДжмоль -1 ) | 1-й | 2-я | 3-й | 4-я | 5-й | 6-й | 7-й |
| 1402.328 | 2856.092 | 4578.156 | 7475.057 | 9444.969 | 53266.97 | 33603,91 | |
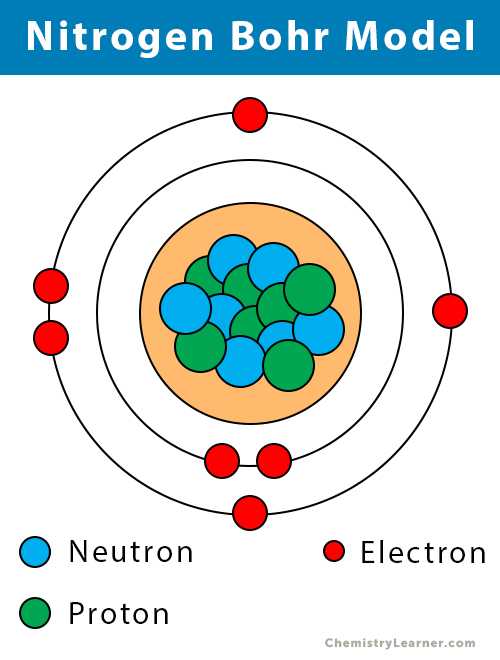
Азотная модель Бора (атомная структура)
Как обычно используется азот
- Шины, заполненные азотом, имеют более стабильное давление, чем шины, заполненные воздухом, что сводит к минимуму возможность утечки [1] .
- Используется при отжиге нержавеющей стали для снижения напряжения и улучшения ее общих функций. [1] .
- Являясь инертным неметаллом, он используется для защиты полупроводниковых устройств, таких как светодиоды и транзисторы [1, 2] .
- Жидкий азот - эффективный криоген, используемый в медицинском распылительном оборудовании для удаления бородавок, доброкачественных опухолей и злокачественных новообразований, а также для лечения других кожных проблем [8] . Он также используется в качестве хладагента для хранения донорских органов, яйцеклеток, спермы и других клеток организма для медицинских целей и научных исследований. Кроме того, он помогает дольше хранить продукты [1] .
- Органический азот является важным химическим компонентом удобрений, нейлона, красителей, азотной кислоты и взрывчатых веществ [1] .
- Сварочные аппараты для азотной пластмассы используются при ремонте пластмассовых деталей автомобилей путем удаления кислорода [9] .
- Азотистый иприт, разновидность иприта, состоящего из азота, используется в качестве химиотерапевтических средств при лечении рака [10] .
Элемент токсичен
Вдыхание большого количества N 2 может привести к удушью, слабости и потере сознания [4] .Глубоководные водолазы склонны к состоянию, называемому наркозом, которое проявляется такими симптомами, как галлюцинации, дезориентация, потеря концентрации и кратковременная потеря памяти в результате повышенного давления азота в крови [11] . Попадание жидкой формы неметалла на кожу и в глаза может вызвать некоторые опасные эффекты, такие как обморожение, боль и ожоги. [4] .

Азот жидкий
Интересные факты
- Это основная составляющая белков и нуклеиновых кислот (ДНК и РНК) в организме большинства живых организмов [4] .
- Во времена египетской цивилизации его получали путем нагревания смеси навоза, соли и мочи [1] .
- Азот иногда называют «дефлогистированным» или «сгоревшим», поскольку, как только весь кислород забирается из воздуха, он состоит только из бывшего [12] .
Стоимость азота
Поскольку он продается в виде баллонов, стандартный 50-литровый будет стоить около 150 долларов, в то время как цена жидкого азота колеблется где-то в пределах 0 долларов.50 и 0,60 доллара за галлон.
Список литературы
- http://www.rsc.org/periodic-table/element/7/nitrogen
- https://education.jlab.org/itselemental/ele007.html
- https://www.chemicool.com/elements/nitrogen.html
- https://pubchem.ncbi.nlm.nih.gov/compound/Nitrogen#section=Top
- https://hobart.k12.in.us/ksms/PeriodicTable/nitrogen.htm
- https://chem.libretexts.org/Textbook_Maps/Inorganic_Chemistry/Supplemental_Modules_(Inorganic_Chemistry)/Descriptive_Chemistry/Elements_Organized_by_Block/2_p-Block_Elements/Group_15%3Chemistry_TheFilm_Elements/Group_15%3_DOM_Group_15%3_DHM_S_D_Group_15%
- https: // opencurriculum.org / 9436 / химические-свойства-азота /
- https://www.aafp.org/afp/2004/0515/p2365.html
- https://rts.i-car.com/collision-repair-news/nitrogen-hot-air-welding.html
- http://cutaneouslymphoma.stanford.edu/community/mustargen.html
- https://www.oughttco.com/what-is-nitrogen-narcosis-2963052
- https://www.oughttco.com/nitrogen-facts-606568
Что такое азот? (с иллюстрациями)
Азот - это неметаллический химический элемент без запаха, вкуса и цвета, который в большом количестве присутствует в атмосфере Земли. Он также присутствует в ряде других соединений и является жизненно важным компонентом жизни на Земле для многих организмов. Помимо вдыхания азота при каждом вдохе, большинство организмов также ежедневно потребляет его с пищей. На рынке имеется множество различных форм, от жидкого азота для переохлаждения до закиси азота, типа анестетика.
Азот имеет атомный номер 7, и он обозначен в периодической таблице элементов символом N.Газ - самый легкий из азотной группы химических элементов с атомным номером семь. Он обозначен в периодической таблице элементов символом N.Другие элементы в группе включают висмут, сурьму и мышьяк. Азот образует прочные связи с другими элементами, потому что его внешняя электронная оболочка лишена трех электронов. Эти связи делают его очень стабильным, поэтому иногда его используют в качестве буферного газа.
Жидкий азот часто используется в криогенике.Примерно 4/5 атмосферы Земли состоит из азота, и этот элемент является седьмым по распространенности во Вселенной. Хотя большинство животных не могут использовать азот в чистом виде, они считают его необходимым для жизни в форме таких соединений, как аминокислоты и нуклеиновые кислоты. Растения также используют этот элемент для питания, причем некоторые растения хорошо известны как фиксаторы азота, что означает, что они эффективно улавливают его для использования другими организмами.
Жидкий азот часто используется в качестве хладагента.Элемент был впервые выделен в 1772 году, хотя исследователи знали о его существовании еще до этого периода.Ученые, конечно, знали, что воздух без кислорода не является дышащим и негорючим, и они знали об азотной кислоте, соединении, содержащем азот, задолго до 1772 года. Современные способы использования азота включают его использование в качестве инертного газа в упаковке, где кислород нежелателен или опасно, как и многие продукты питания и взрывчатые вещества.
Чистый газообразный азот представляет несколько рисков для здоровья человека.В первом смысле он может действовать как удушающее средство, вытесняя доступный кислород в воздухе. Этот риск представляет собой серьезную проблему с жидким азотом, который быстро переходит в газообразную форму при комнатной температуре. При работе с жидкостью очень важна правильная вентиляция. Кроме того, газ вызывает состояние, называемое декомпрессионной болезнью, распространенное у дайверов. Декомпрессионная болезнь, также известная как «изгиб», характеризуется наличием в крови пузырьков азота и других газов, образующихся в результате внезапного сброса давления.
Закись азота - это анестезирующий газ, который обычно дают пациентам, проходящим медицинские процедуры. .азота | Факты, определение, использование, свойства и открытие
Азот (N) , неметаллический элемент 15 группы [Va] периодической таблицы Менделеева. Это бесцветный газ без запаха и вкуса, который является наиболее распространенным элементом атмосферы Земли и входит в состав всего живого вещества.
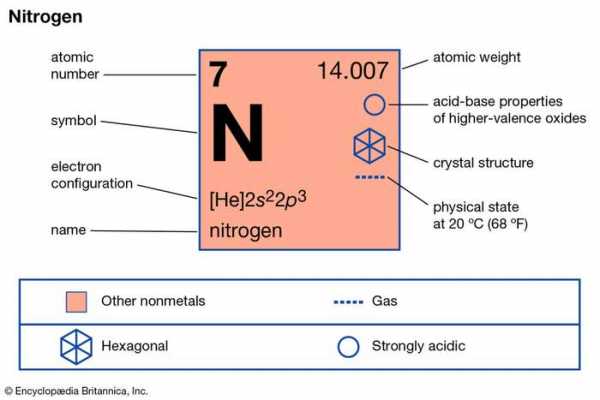 Encyclopædia Britannica, Inc.
Encyclopædia Britannica, Inc. 
Британская викторина
118 Названия и символы из таблицы Менделеева
Ар
| атомный номер | 7 |
|---|---|
| атомный вес | 14.0067 |
| точка плавления | −209,86 ° C (−345,8 ° F) |
| точка кипения | −195,8 ° C (−320,4 ° F) |
| плотность (1 атм, 0 ° C) | 1,2506 г / л |
| обычные степени окисления | −3, +3, +5 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 3 |
История
Около четырех пятых атмосферы Земли - это азот, который был выделен и признан особенным веществом во время ранних исследований воздуха.Карл Вильгельм Шееле, шведский химик, показал в 1772 году, что воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», потому что он поддерживает горение, а другой «грязным воздухом», потому что он остался после « огненный воздух ». «Огненный воздух» - это, конечно, кислород, а «грязный воздух» - азот. Примерно в то же время азот был признан шотландским ботаником Дэниелом Резерфордом (который первым опубликовал свои открытия), британским химиком Генри Кавендишем и британским священником и ученым Джозефом Пристли, который вместе с Шееле дается заслуга в открытии кислорода.Более поздние работы показали, что новый газ является составной частью селитры, общего названия нитрата калия (KNO 3 ), и, соответственно, французский химик Жан-Антуан-Клод Шапталь в 1790 году назвал его азотом. считался химическим элементом Антуаном-Лораном Лавуазье, чье объяснение роли кислорода в горении в конечном итоге опровергло теорию флогистона, ошибочное представление о горении, которое стало популярным в начале 18 века. Неспособность азота поддерживать жизнь (по-гречески: zoe ) побудила Лавуазье назвать его азот , по-прежнему французский эквивалент азота .
Возникновение и распространение
Среди элементов азот занимает шестое место по количеству в космосе. Атмосфера Земли состоит из 75,51 процента по весу (или 78,09 процента по объему) азота; это основной источник азота для торговли и промышленности. Атмосфера также содержит различные небольшие количества аммиака и солей аммония, а также оксидов азота и азотной кислоты (последние вещества образуются во время грозы и в двигателе внутреннего сгорания).Свободный азот содержится во многих метеоритах; в газах вулканов, шахт и некоторых минеральных источников; на солнце; и в некоторых звездах и туманностях.
Азот также присутствует в минеральных отложениях селитры или селитры (нитрат калия, KNO 3 ) и чилийской селитры (нитрат натрия, NaNO 3 ), но эти отложения существуют в количествах, которые совершенно не соответствуют потребностям человека. Еще один богатый азотом материал - гуано, которое можно найти в пещерах летучих мышей и в сухих местах, часто посещаемых птицами.В сочетании азот содержится в дожде и почве в виде аммиака и солей аммония, а в морской воде - в виде аммония (NH 4 + ), нитрита (NO 2 - ) и нитрата (NO 3 ). - ) ионы. Азот составляет в среднем около 16 процентов по массе сложных органических соединений, известных как белки, присутствующих во всех живых организмах. Естественное содержание азота в земной коре составляет 0,3 части на 1000 человек. Космическое содержание - предполагаемое общее содержание во Вселенной - составляет от трех до семи атомов на атом кремния, что считается стандартом.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодняИндия, Россия, США, Тринидад и Тобаго и Украина входили в пятерку крупнейших производителей азота (в форме аммиака) в начале 21 века.
Коммерческое производство и использование
Промышленное производство азота в основном осуществляется путем фракционной перегонки сжиженного воздуха. Температура кипения азота составляет -195,8 ° C (-320,4 ° F), что примерно на 13 ° C (-23 ° F) ниже, чем у кислорода, который поэтому остается позади.Азот также можно производить в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения образующихся диоксида углерода и воды от остаточного азота. В небольших масштабах чистый азот получают путем нагревания азида бария, Ba (N 3 ) 2 . Различные лабораторные реакции с образованием азота включают нагревание растворов нитрита аммония (NH 4 NO 2 ), окисление аммиака бромной водой и окисление аммиака горячим оксидом меди.
Элементарный азот можно использовать в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги.В жидком состоянии азот имеет ценные криогенные применения; за исключением газов водорода, метана, окиси углерода, фтора и кислорода, практически все химические вещества имеют пренебрежимо малое давление пара при температуре кипения азота и поэтому существуют в виде кристаллических твердых веществ при этой температуре.
В химической промышленности азот используется для предотвращения окисления или другого порчи продукта, в качестве инертного разбавителя реактивного газа, в качестве носителя для отвода тепла или химикатов, а также в качестве ингибитора пожара или взрывов.В пищевой промышленности газообразный азот используется для предотвращения порчи из-за окисления, плесени или насекомых, а жидкий азот используется для сублимационной сушки и для холодильных систем. В электротехнической промышленности азот используется для предотвращения окисления и других химических реакций, для создания избыточного давления в оболочках кабелей и для защиты двигателей. Азот находит применение в металлургической промышленности при сварке, пайке и пайке, где он помогает предотвратить окисление, науглероживание и обезуглероживание. Как инертный газ, азот используется для производства вспененного или вспененного каучука, пластмасс и эластомеров, в качестве газа-вытеснителя для аэрозольных баллончиков и для повышения давления жидких пропеллентов для реакционных струй.В медицине быстрое замораживание жидким азотом может использоваться для сохранения крови, костного мозга, тканей, бактерий и спермы. Жидкий азот также оказался полезным в криогенных исследованиях.
.фактов об азоте | Живая наука
Азот необходим для жизни на Земле. Это компонент всех белков, и его можно найти во всех живых системах. Соединения азота присутствуют в органических материалах, продуктах питания, удобрениях, взрывчатых веществах и ядах. Азот имеет решающее значение для жизни, но его избыток также может быть вредным для окружающей среды.
Названный в честь греческого слова nitron , обозначающего «природная сода», и генов , обозначающего «формирование», азот является пятым по распространенности элементом во Вселенной.По данным Лос-Аламосской национальной лаборатории, газообразный азот составляет 78 процентов воздуха Земли. С другой стороны, атмосфера Марса состоит всего на 2,6 процента азота.
В газообразной форме азот не имеет цвета, запаха и обычно считается инертным. По словам Лос-Аламоса, в жидкой форме азот также не имеет цвета и запаха и похож на воду.
Только факты
- Атомный номер (количество протонов в ядре): 7
- Атомный символ (в Периодической таблице элементов): N
- Атомный вес (средняя масса атома): 14.0067
- Плотность: 0,0012506 граммов на кубический сантиметр
- Фаза при комнатной температуре: газ
- Точка плавления: минус 321 градус по Фаренгейту (минус 210 градусов Цельсия)
- Точка кипения: минус 320,42 F (минус 195,79 C)
- Количество изотопов (атомов одного элемента с разным числом нейтронов): 16, включая 2 стабильных
- Наиболее распространенные изотопы: Азот-14 (содержание: 99,63 процента)
Азот (Изображение предоставлено: general-fmv, Андрей Маринкас Shutterstock)
Компонент удобрения
Азот был открыт в 1772 году химиком и врачом Дэниелом Резерфордом, когда он удалил кислород и углекислый газ из воздуха, продемонстрировав, что остаточный газ не поддерживает живые организмы или горение, согласно Лос-Аламосской национальной лаборатории.Другие ученые, в том числе Карл Вильгельм Шееле и Джозеф Пристли, работали над той же проблемой и называли азот «обожженным» воздухом или воздухом без кислорода. В 1786 году Антуан Лоран де Лавуазье назвал азот азотом, что означает «безжизненный». Это было основано на наблюдении, что часть воздуха не может поддерживать жизнь сама по себе.
Одним из наиболее важных соединений азота является аммиак (NH 3 ), который может быть произведен в так называемом процессе Габера-Боша, в котором азот реагирует с водородом.Бесцветный газообразный аммиак с резким запахом можно легко превратить в азотное удобрение. Фактически, около 80 процентов производимого аммиака используется в качестве удобрений. Он также используется в качестве хладагента; в производстве пластмасс, текстиля, пестицидов и красителей; и в чистящих растворах, по данным Государственного департамента Нью-Йорка.
Азотный цикл
Азотный цикл, в котором атмосферный азот превращается в различные органические соединения, является одним из наиболее важных естественных процессов для поддержания жизни живых организмов.Во время цикла бактерии в почве обрабатывают или «фиксируют» атмосферный азот в аммиак, который необходим растениям для роста. Другие бактерии превращают аммиак в аминокислоты и белки. Затем животные едят растения и потребляют белок. Соединения азота возвращаются в почву с отходами животноводства. Бактерии превращают отработанный азот обратно в газообразный азот, который возвращается в атмосферу.
Стремясь ускорить рост сельскохозяйственных культур, люди используют азот в удобрениях. Однако чрезмерное использование этих удобрений в сельском хозяйстве имело разрушительные последствия для окружающей среды и здоровья человека, поскольку способствовало загрязнению подземных и поверхностных вод.По данным Агентства по охране окружающей среды США (EPA), загрязнение питательными веществами, вызванное избытком азота и фосфора в воздухе и воде, является одной из наиболее распространенных, дорогостоящих и сложных экологических проблем.
Устранение дисбаланса
Одно из решений проблемы избыточного азота заключается в устойчивом сельском хозяйстве, органическом земледелии и повышении осведомленности фермеров об этих экологических проблемах, по словам Рэнди А. Дальгрена, профессора почвоведения Университета Калифорния, Дэвис.
«Идея заключалась бы в том, чтобы попытаться отказаться от использования этих коммерческих удобрений и вместо этого использовать органические отходы», например, отходы животноводства, - сказал он. Другим шагом было бы использование удобрений с медленным высвобождением, которые имеют пластиковое покрытие, и вместо того, чтобы сразу выделять азот, высвобождение азота происходит постепенно в течение всего вегетационного периода, «пытаясь сопоставить выделение азота из удобрений с пластиковым покрытием с потребности завода ", - сказал он.
Микробиологи из Университета Альберты в Канаде и Венского университета в Австрии, возможно, обнаружили другое решение.В августе 2017 года исследователи объявили, что идентифицировали микроб, окисляющий аммиак, под названием Nitrospira inopinata .
По словам исследователей, Nitrospira inopinata - это аммиачная губка, которая существенно превосходит почти все другие типы бактерий и архей (одноклеточные организмы) в окислении аммония в окружающей среде. Поскольку этот микроб является таким эффективным окислителем, он может производить меньше закиси азота в процессе.
Новые открытия, опубликованные в научном журнале Nature, могут иметь важное значение для исследований изменения климата.Исследователи готовы испытать этот микроб с помощью различных практических приложений, которые могут снизить уровень аммония в почве, воде и атмосфере. По данным Университета Альберты, некоторые из этих приложений могут включать изменения в нашей питьевой воде, очистке сточных вод и очистке почвы.
Кто знал?
- Несмотря на то, что термин «азот» используется в английском языке для обозначения этого элемента, термин «азот» Лавуазье все еще используется во французском языке, и его форма присутствует в «азото» на итальянском языке или «азот» на польском языке.
- По данным Королевского химического общества, жидкий азот часто используется в качестве хладагента, например, для хранения спермы, яйцеклеток и других клеток, используемых в медицинских исследованиях или клиниках репродуктивной медицины.
- Жидкий азот также используется для быстрой заморозки продуктов и помогает сохранить их вкус, текстуру, влажность и аромат.
- По данным Лаборатории реактивного движения, азот составляет 95 процентов атмосферы Титана (крупнейшего спутника Сатурна).
- Газообразный азот играет роль в формировании полярного сияния - естественного проявления света в небе, которое можно преимущественно наблюдать в регионах Арктики и Антарктики, - которое возникает, когда быстро движущиеся из космоса электроны сталкиваются с кислородом и азотом в нашей атмосфере. по данным НАСА.
- Газообразный азот можно получить путем нагревания водного раствора нитрата аммония (Nh5NO3), твердого кристаллического вещества, которое обычно используется в удобрениях.
- По данным Королевского химического общества, ежегодно с использованием процесса Габера производится около 150 тонн аммиака.
- По данным Королевского химического общества, азот в форме хлорида аммония, Nh5Cl, производился в Древнем Египте путем нагревания смеси экскрементов животных, мочи и соли.
- Нитроглицерин, сильнодействующее взрывчатое вещество, используемое при производстве динамита, представляет собой маслянистую бесцветную жидкость, содержащую азот, кислород и углерод.
Дополнительный отчет от Трейси Педерсен, сотрудника Live Science.
Дополнительные ресурсы
- На этом веб-сайте описано, что происходит, когда вы пытаетесь поместить различные предметы в жидкий азот.
- Эта инфографика иллюстрирует загрязнение азотом Чесапикского залива.