Укажите при взаимодействии растворов каких веществ одним из продуктов
| Тема: Электролитическая диссоциация (Реакции ионного обмена и гидролиз солей) Условие задачи полностью выглядит так:
Задача из главы Электролитическая диссоциация по предмету Химия из задачника Химия 8-9. Дидактический материал, Радецкий (9 класс) Если к данной задачи нет решения - не переживайте. Наши администраторы стараются дополнять сайт решениями для тех задач и упражнения где это требуется и которые не даны в решебниках и сборниках с ГДЗ. Попробуйте зайти позже. Вероятно, вы найдете то, что искали :) |
7.5: Водные растворы и растворимость - соединения, растворенные в воде
Цели обучения
- Определите и приведите примеры электролитов
Когда некоторые вещества растворяются в воде, они претерпевают физические или химические изменения, в результате которых образуются ионы в растворе. Эти вещества составляют важный класс соединений, называемых электролитами. Вещества, не выделяющие ионы при растворении, называются неэлектролитами. Если физический или химический процесс, в результате которого образуются ионы, практически на 100% эффективен (все растворенное соединение дает ионы), то это вещество известно как сильный электролит.Если только относительно небольшая часть растворенного вещества подвергается процессу образования ионов, это называется слабым электролитом.
Вещества можно определить как сильные, слабые или неэлектролиты путем измерения электропроводности водного раствора, содержащего это вещество. Чтобы проводить электричество, вещество должно содержать свободно подвижные заряженные частицы. Наиболее знакомо проведение электричества по металлическим проводам, и в этом случае подвижными заряженными объектами являются электроны.Растворы могут также проводить электричество, если они содержат растворенные ионы, причем проводимость увеличивается с увеличением концентрации ионов. Подача напряжения на электроды, погруженные в раствор, позволяет оценить относительную концентрацию растворенных ионов либо количественно, измеряя электрический ток, либо качественно, наблюдая за яркостью лампочки, включенной в цепь (Рисунок \ (\ PageIndex) {1} \)).
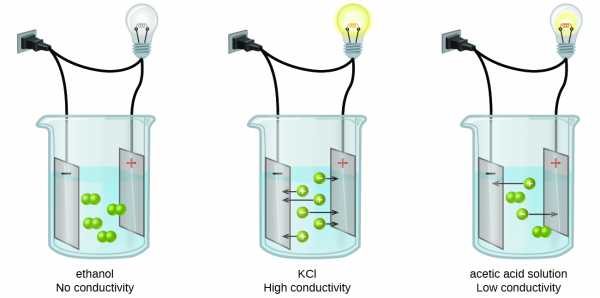 Рисунок \ (\ PageIndex {1} \): Растворы неэлектролитов, таких как этанол, не содержат растворенных ионов и не могут проводить электричество.Растворы электролитов содержат ионы, которые пропускают электричество. Электропроводность раствора электролита связана с прочностью электролита.
Рисунок \ (\ PageIndex {1} \): Растворы неэлектролитов, таких как этанол, не содержат растворенных ионов и не могут проводить электричество.Растворы электролитов содержат ионы, которые пропускают электричество. Электропроводность раствора электролита связана с прочностью электролита. Ионные электролиты
Вода и другие полярные молекулы притягиваются к ионам, как показано на рисунке \ (\ PageIndex {2} \). Электростатическое притяжение между ионом и молекулой с диполем называется ионно-дипольным притяжением. Эти аттракционы играют важную роль в растворении ионных соединений в воде.
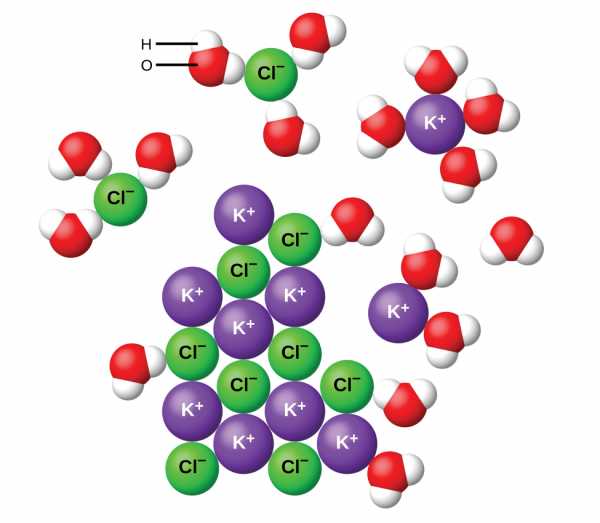 Рисунок \ (\ PageIndex {2} \): Когда хлорид калия (KCl) растворяется в воде, ионы гидратируются. Полярные молекулы воды притягиваются зарядами на ионах K + и Cl - . Молекулы воды перед ионами и за ними не показаны.
Рисунок \ (\ PageIndex {2} \): Когда хлорид калия (KCl) растворяется в воде, ионы гидратируются. Полярные молекулы воды притягиваются зарядами на ионах K + и Cl - . Молекулы воды перед ионами и за ними не показаны. Когда ионные соединения растворяются в воде, ионы в твердом веществе разделяются и равномерно диспергируются по всему раствору, поскольку молекулы воды окружают ионы и сольватируют их, уменьшая сильные электростатические силы между ними.Этот процесс представляет собой физическое изменение, известное как диссоциация. В большинстве условий ионные соединения при растворении почти полностью диссоциируют, поэтому они классифицируются как сильные электролиты.
Давайте посмотрим, что происходит на микроскопическом уровне, когда мы добавляем твердый KCl в воду. Ионно-дипольные силы притягивают положительный (водородный) конец полярных молекул воды к отрицательным ионам хлорида на поверхности твердого тела, а отрицательные (кислородные) концы - к положительным ионам калия.Молекулы воды проникают между отдельными ионами K + и Cl - и окружают их, уменьшая сильные межионные силы, которые связывают ионы вместе, и позволяют им переходить в раствор в виде сольватированных ионов, как показано на рисунке \ (\ PageIndex {2} \) показывает. Уменьшение электростатического притяжения позволяет каждому гидратированному иону в разбавленном растворе двигаться независимо, что приводит к увеличению беспорядка в системе, когда ионы меняют свои фиксированные и упорядоченные положения в кристалле на подвижные и гораздо более неупорядоченные состояния в решение.Этот повышенный беспорядок ответственен за растворение многих ионных соединений, включая KCl, которые растворяются с поглощением тепла.
В других случаях электростатическое притяжение между ионами в кристалле настолько велико или ионно-дипольные силы притяжения между ионами и молекулами воды настолько слабы, что увеличение беспорядка не может компенсировать энергию, необходимую для разделения ионов. , и кристалл нерастворим. Так обстоит дело с такими соединениями, как карбонат кальция (известняк), фосфат кальция (неорганический компонент кости) и оксид железа (ржавчина).
Правила растворимости
Некоторые комбинации водных реагентов приводят к образованию твердого осадка в виде продукта. Однако при некоторых комбинациях такой продукт не получается. Если смешать растворы нитрата натрия и хлорида аммония, реакции не происходит. Можно было бы написать молекулярное уравнение, показывающее реакцию двойного замещения, но оба продукта, хлорид натрия и нитрат аммония, растворимы и останутся в растворе в виде ионов. Каждый ион является ионом-наблюдателем, и нет никакого общего ионного уравнения.Полезно иметь возможность предсказать, когда в реакции произойдет осадок. Для этого вы можете использовать набор руководящих принципов, называемых правилами растворимости (Таблицы \ (\ PageIndex {1} \) и \ (\ PageIndex {2} \)).
| Растворим в воде | Важные исключения (неразрешимые) |
|---|---|
| Все группы IA и NH 4 + соли | нет |
| Все нитраты, хлораты, перхлораты и ацетаты | нет |
| Все сульфаты | CaSO 4 , BaSO 4 , SrSO 4 , PbSO 4 |
| Все хлориды, бромиды и иодиды | AgX, Hg 2 X 2 , PbX 2 (X = Cl, Br или I) |
| Умеренно растворим в воде | Важные исключения (растворимые) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Все карбонаты и фосфаты | Группа IA и NH 4 + соли | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Все гидроксиды | Группа IA и NH 4 + соли; Ba 2+ , Sr 2+ , Ca 2+ Трудно растворимый | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Все сульфиды | Группы IA, IIA и NH 4 + соли; Трудно растворимый MgS, CaS, BaS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Все оксалаты | Группа IA и NH 4 + соли | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Особое примечание: Следующие электролиты имеют лишь умеренную растворимость в воде: CH 3 COOAg, Ag 2 SO 4 , KClO 4.-} \ left (aq \ right) \ rightarrow? \ nonumber \] Возможные осадки в результате реакции двойного замещения представляют собой нитрат цезия и бромид свинца (II). Согласно таблице правил растворимости, нитрат цезия растворим, потому что все соединения, содержащие нитрат-ион, а также все соединения, содержащие ионы щелочных металлов, растворимы. Большинство соединений, содержащих бромид-ион, растворимы, но свинец (II) является исключением. Следовательно, ионы цезия и нитрата являются ионами-наблюдателями, а бромид свинца (II) представляет собой осадок.-} \ left (aq \ right) \ rightarrow \ ce {PbBr_2} \ left (s \ right) \ nonumber \] Пример \ (\ PageIndex {1} \): Растворимость Классифицируйте каждое соединение как растворимое или нерастворимое
Решение
Упражнение \ (\ PageIndex {1} \): растворимость Классифицируйте каждое соединение как растворимое или нерастворимое.
СводкаВещества, растворяющиеся в воде с образованием ионов, называются электролитами.Неэлектролиты - это вещества, не образующие ионы при растворении в воде. Правила растворимости позволяют предсказать, какие продукты будут нерастворимы в воде. Добавления и авторствоЭта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или широко) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы: .6.6: Объемы газа и стехиометрияПример 6.6.1 Серная кислота, промышленный химикат, производимый в наибольшем количестве (почти 45 миллионов тонн в год только в Соединенных Штатах), получается путем сжигания серы на воздухе с образованием SO 2 с последующей реакцией SO 2 с O 2 в присутствии катализатора с образованием SO 3 , который реагирует с водой с образованием H 2 SO 4 . Общее химическое уравнение выглядит следующим образом: \ [\ rm 2S _ {(s)} + 3O_ {2 (g)} + 2H_2O _ {(l)} \ rightarrow 2H_2SO_ {4 (aq)} \] Какой объем O 2 (в литрах) при 22 ° C и давлении 745 мм рт. ст. требуется для получения 1.00 тонн (907,18 кг) H 2 SO 4 ? Дано: реакция, температура, давление и масса одного продукта Запрошено: объем газообразного реагента Стратегия: A Рассчитать количество молей H 2 SO 4 в 1,00 тонне. Используя стехиометрические коэффициенты в сбалансированном химическом уравнении, рассчитайте необходимое количество молей O 2 . B Используйте закон идеального газа, чтобы определить объем O 2 , необходимый в данных условиях.5 \; L \] Ответ означает, что для производства 1 тонны серной кислоты необходимо более 300 000 л газообразного кислорода. Эти числа могут дать вам представление о масштабах инженерных и сантехнических проблем, с которыми сталкивается промышленная химия. Упражнение 6.6.1 В примере 5 мы увидели, что Чарльз использовал воздушный шар, содержащий приблизительно 31 150 л H 2 , для своего первого полета в 1783 году. Газообразный водород был получен реакцией металлического железа с разбавленной соляной кислотой. согласно следующему сбалансированному химическому уравнению: \ [Fe _ {(s)} + 2 HCl _ {(aq)} \ rightarrow H_ {2 (g)} + FeCl_ {2 (aq)} \] Сколько железа (в килограммах) было необходимо для производства этого объема H 2 , если температура была 30 ° C, а атмосферное давление было 745 мм рт. Ответ: 68.6 кг Fe (примерно 150 фунтов) .
Расчет эквивалентной массы - MEL Chemistry [Депонировать фотографии] [Депонировать фотографии] Эквивалент вещества, также известный как эквивалентное количество вещества, относится к количеству вещества, которое взаимодействует с одним моль ионов водорода (в кислотно-основной реакции) или электронов (в окислительно-восстановительной реакции). Эквивалентные массы необходимы для правильного расчета химических реакций между веществами.Используя эквиваленты, мы можем получить правильное значение без длинных формул реакции, потому что нам нужно только знать, что химические вещества взаимодействуют, или что вещество является продуктом химической реакции.  [Депонировать фотографии] [Депонировать фотографии] Для начала давайте поговорим о том, что такое эквивалент вещества. Согласно классическому определению, эквивалент вещества - это условная или реальная частица, которая может быть эквивалентна катиону водорода в ионообменных и кислотно-основных реакциях или электрону в окислительно-восстановительных реакциях. Любое вещество имеет несколько определяющих характеристик, и его эквивалентная масса, обозначенная как M экв, является одной из самых важных из всех. Молярную массу вещества легко определить: просто сложите молярные массы атомов в химической формуле вещества. Молярная масса вещества - это лишь один из нескольких параметров, необходимых для правильного расчета эквивалентности. Некоторые рекомендации по поиску эквивалента вещества Формула для определения эквивалентной массы вещества зависит от класса рассматриваемого соединения.Для оксидов легко найти эквивалентную массу, например: разделите молярную массу соединения на валентность некислородного элемента, умноженную на количество его атомов. Давайте посмотрим на эквивалентную массу оксида золота (III) по формуле Au₂O₃.  [Депонировать фотографии] [Депонировать фотографии] Путем несложных вычислений получаем: (197x2 + 16x3) / 3x2 = 73.7 г / моль. Чтобы рассчитать эквивалентную массу основания, просто разделите молярную массу основания на количество гидроксильных групп. Возьмем, например, гидроксид кальция Ca (OH) ₂. Несколько простых вычислений дают эквивалент 37 г / моль. Чтобы найти эквивалент кислоты, разделите молярную массу кислоты на количество протонов. Вот простой пример использования серной кислоты: (1x2 + 32x1 + 16x4) / 2 = 49 г / моль.  [Депонировать фотографии] [Депонировать фотографии] Найти эквивалент соли также просто: умножьте количество атомов металла на их степень окисления, затем разделите его молярную массу на результат.Щелкните здесь, чтобы узнать о некоторых безопасных химических экспериментах, которые углубят этот вопрос. Эксперименты по определению эквивалентной массы веществаЭтот эксперимент весьма интересен, и его можно использовать для демонстрации того, как вычислить эквивалентную массу вещества. Но делать это нужно с особой осторожностью: перед проведением любого эксперимента обязательно ознакомьтесь с необходимой научной литературой и методиками проведения экспериментов. Внимание! Не пытайтесь проводить этот эксперимент без профессионального надзора! Вам понадобится:
 [Депонировать фотографии] [Депонировать фотографии] Если кислота случайно коснется кожи, промойте пораженный участок проточной водой и используйте пищевую соду для нейтрализации кислоты. Этот метод основан на измерении объема водорода, выделяемого в результате реакции между металлом и кислотой. Эквивалент цинка определяется с помощью бюретки, соединенной трубкой с воронкой и пробиркой. Аппарат функционирует как система сообщающихся сосудов. Заполните бюретку водой. С помощью пипетки налейте на дно пробирки несколько миллилитров соляной кислоты. Наклоните пробирку и вставьте кусочек цинка, следя за тем, чтобы он не касался кислоты.Отрегулируйте высоту воронки, чтобы довести уровень воды в бюретке до «0». Закройте пробирку пробиркой и выбейте цинк в кислоту. Вы увидите заметное выделение газообразного водорода, который вытеснит часть воды из бюретки. Обратите внимание на разницу начального и конечного уровней воды в бюретке, чтобы измерить, сколько газа было выпущено. Принимая во внимание температуру в лаборатории, атмосферное давление и давление водяного пара в бюретке, вы можете вычислить эквивалентную массу металла по правильной формуле с достаточной точностью.Кстати, если вас интересует, как на температуру воды можно влиять, растворяя в ней вещества, вы можете попробовать этот эксперимент. . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||