Продукты содержащие азот таблица
где его больше всего, список продуктов питания, богатых данным элементом
Азот входит в состав земной атмосферы в молекулярном виде, на него приходится 76% атмосферы по массе.
В связанном состоянии элемент встречается в почве и воде в виде химических соединений.
В живых организмах (растениях и животных) азот представлен в составе органических соединений, входит в аминокислоты в количестве от 15% до 18%.
к оглавлению ↑Как влияет на организм
В начале 20 века было установлено, что для обеспечения жизнедеятельности живых организмов необходимо регулярное поступление в них некоторых химических соединений, включая азот.

В теле мужчины содержится в среднем 1,8 кг элемента, а женщины – 1,3 кг. Такая разница обусловлена тем, что белки входят в состав мышечной ткани, а у мужчин мышцы развиты сильнее, чем у женщин.
Для человека атмосферный азот является биологически неактивным веществом, поступающим в легкие с вдыхаемым воздухом и выводимым с выдыхаемым.
Потребность человека в белке складывается из 2 компонентов – удовлетворение потребности в общем азоте и в незаменимых аминокислотах.
Белковые соединения для синтеза своих тканей человек получает из пищи, которая должна содержать достаточное их количество.
Из необходимых организму аминокислот некоторые (называемые заменимыми) синтезируются в организме из аммиака и иных веществ, а несинтезируемые (называемые незаменимыми) должны поступать с пищей (растительной и животной).
Чтобы атмосферный азот оказался в составе белков, он должен претерпеть ряд превращений. Использовать его напрямую способны лишь живущие в почве бактерии рода Азотобактер с дальнейшим синтезом органических азотистых соединений.
Все остальные живые организмы не способны использовать атмосферный азот. У них азотистый обмен начинается с использования аммиака или аминокислот.
Аммиак образуют высшие растения путем восстановления содержащихся в почве нитратов с конечным биосинтезом аминокислот и белков.
Травоядные животные питаются растениями и превращают аминокислоты растений в собственные белки. Человек потребляет растительные и животные продукты и также превращает их в собственные ткани.
После смерти живых организмов микроорганизмы расщепляют органические вещества, азот поступает в почву, где ассимилируется азотфиксирующими бактериями и вновь превращается в органические вещества. Это и есть кругооборот азота в природе.
к оглавлению ↑Потребность человека в белке, симптомы дефицита
В конце 19 века было окончательно установлено, что при нормальных условиях организм человека находится в состоянии азотистого равновесия, т. е. поступление азота с пищей равняется количеству элемента в выделяемых с мочой азотистых веществах (мочевине).

Количество выделяемой взрослым человеком мочевины зависит от количества потребляемой белковой пищи и обычно составляет 25-35 г в сутки.
Азотистый баланс нарушается при голодании или недостатке в пище белков. Длительное состояние отрицательного азотистого баланса (когда азота выводится больше, чем поступает) ведет к гибели организма.
Положительный азотистый баланс наблюдается в период восстановления после голодания или истощения. Нормальным является положительный азотистый баланс у растущих детей и подростков до периода прекращения их роста.
Для поддержания азотистого равновесия человеку, по нормам Всемирной организации здравоохранения, достаточно потреблять ежесуточно 0,8 г полноценного по аминокислотному составу белка на каждый килограмм своего веса.
При смешанном растительно-животном питании потребность в связи со снижением усвояемости возрастает и доходит до 1,0 г/кг. Под весом при данном расчете понимается нормальный (идеальный) вес без учета избыточной жировой ткани, например, по формуле «Рост минус 105».
При перечисленных ниже состояниях потребность в белке (и в азоте) увеличивается:
- стрессы;
- заболевания и травмы;
- после хирургических операций;
- беременность;
- грудное вскармливание;
- интенсивная физическая нагрузка.

При избыточном весе и похудении на сниженном по калорийности рационе также необходимо увеличить норму белка до 1,2-1,3 г/кг.
Но здесь нужна мера – потребление белка в количестве свыше 1,5 г/кг нежелательно, а свыше 2 г/кг — вредно.
Рекомендации по потреблению больших доз отдельных аминокислот или их комбинаций в виде добавки для спортсменов силовых видов спорта и бодибилдеров не подтверждаются, а применение чистых аминокислот считается неблагоприятным для здоровья, тем более, если они поступают взамен белковой пищи.
В чистом виде белковая недостаточность встречается редко. Это следствие общего недоедания, т. е. недостаточности калорийности рациона. Состояние при одновременном глубоком дефиците белка и энергии называется маразмом.
К социальным причинам недостаточности питания относятся:
- стихийные бедствия;
- войны;
- терроризм.
Поражает белково-энергетическая недостаточность беднейшие слои населения.
В развитых странах белково-калорийная недостаточность может наступать, как следствие заболеваний, хронического алкоголизма и наркомании, со снижением потребления пищи и нарушением ее усвоения.
Симптомы белково-калорийной недостаточности:
- задержка роста детей;
- слабость и потеря мышечной массы, что ведет к снижению веса тела;
- развитие обширных отеков;
- сухость и шелушение кожных покровов;
- образование медленно заживающих гноящихся язв;
- выпадение и обесцвечивание волос;
- потеря аппетита, тошнота;
- рвота с последующим обезвоживанием;
- анемия;
- снижение иммунитета.

Где его содержание больше всего, рекомендации по употреблению
Наиболее полноценные по аминокислотному составу белки содержатся в животных продуктах – мясе, рыбе, молочных продуктах, яйцах.
Достаточно белка и в крупах, макаронных изделиях, хлебе, бобовых (сое, чечевице, фасоли, бобах), в орехах и семечках.
Ниже в таблице приведена информация о том, в чем (в каких продуктах питания) содержится белок (азот).
| Продукт | Содержание белка, г/100 г продукта |
| Говядина | 20-22 |
| Свинина | 14-19 |
| Яйца | 12,7 |
| Колбасы, сосиски, сардельки | 9-14 |
| Рыба | 13-23 |
| Молоко и кисломолочные продукты | 2,6-4,3 |
| Творог | 14-18 |
| Сыр | 23-31 |
| Крупы | 7-13 |
| Хлеб | 5-8 |
| Бобовые | 22-23 |
| Овощи | 0,6-4 |
| Картофель | 2 |
| Фрукты | 0,2-2 |
| Орехи | 12-25 |
Еще больше информации о продуктах, богатых белком (азотом) в этом видео:
к оглавлению ↑Допустимо ли сочетать белковые продукты с углеводными
Следующий из системы раздельного питания запрет на совместное употребление белковых и углеводных продуктов теорией рационального питания не обосновывается, да и эволюционно человек приспособлен к потреблению смешанной пищи.
Для полноценного усвоения белка необходимо оптимальное соотношение в нем аминокислот; этому условию отвечает смешанное растительно-животное питание.
Соблюдая рекомендации по разнообразному питанию и нормам потребления белка, удается обеспечить организм достаточным количеством белка и аминокислот без приема пищевых добавок.
к оглавлению ↑Дополнительные рекомендации и советы
Помимо белков, азот включен и в состав азотсодержащих экстрактивных веществ и пуриновых оснований.

Содержащие азот экстрактивные вещества возбуждают железы желудка и способствуют лучшему усвоению белков и жиров в продуктах питания и еде.
Однако эти вещества оказывают и неблагоприятное воздействие на нервную систему, что осложняет течение болезней органов кровообращения, желудочно-кишечного тракта, почек и нервной системы.
Поэтому из диетического питания исключаются первые блюда на мясных и рыбных бульонах, жареные или тушеные вторые блюда.
Пуриновые основания нарушают обменные процессы в организме, что приводит к задержке мочевой кислоты и отложениям ее солей в тканях — основной причине подагры.
Но пуриновые основания являются также обязательным компонентом питания, и их оптимальный уровень в организме поддерживается употреблением хорошо вываренного мяса.
На Земле химический элемент азот присутствует в атмосфере, составляя большую ее часть. Азот входит в состав белков живых организмов, но они не способны усваивать атмосферный азот напрямую.
Азот поступает к ним с белковой пищей или из содержащихся в почве нитратов. В начале цепи превращения атмосферного азота в белки стоят живущие в почве бактерии рода Азотобактер.
Вконтакте
Одноклассники
Мой мир
Фактов об азоте, Символ, Открытие, Свойства, Использование
Что такое азот
Азот (произносится как Nye-treh-gen) - химический элемент, существующий в форме бесцветного двухатомного газа. Обозначается химическим символом N, он принадлежит к семейству неметаллов. Это пятый по содержанию элемент в земной коре, представленный молекулярной формулой N 2 [1, 2] . Существует 12 изотопов азота с массами от 11 до 19, из которых только N-14 и N-15 встречаются в природе [3] .

Обозначение азота
Где находится азот
В земной атмосфере он составляет около 78% воздуха, который оценивается примерно в 4000 триллионов тонн. Извлекается из сжиженного воздуха фракционной перегонкой [1, 2] .
История
Происхождение его названия: Оно происходит от греческих слов «нитрон» и «гены», которые означают образование нитра. [1] .
Кто открыл это: Дэниел Резерфорд [1]
Когда, где и как было обнаружено
Впервые он был получен в 1760-х годах двумя английскими учеными Генри Кавендишем и Джозефом Пристли при попытке отделить кислород от воздуха.Однако они не смогли подтвердить наличие нового газообразного элемента в атмосфере. Только в сентябре 1772 года в Эдинбурге, Шотландия, Резерфорд назвал его азотом после тщательного анализа [1] .
Азот
Идентификационный номер | |||
| Атомный номер | 7 [1] | ||
| Номер CAS | 7727-37-9 [1] | ||
| Позиция в таблице Менделеева [1] | Группа | Период | Блок |
| 15 | 2 | с. | |
Расположение азота в Периодической таблице
Классификация, свойства и характеристики азота
Общие свойства | ||
| Относительная / средняя атомная масса | 14.007 [1] | |
| Атомная масса / вес | 14.007 атомных единиц массы [5] | |
| Молярная масса / молекулярный вес | 28,014 г / моль [4] | |
| Массовое число | 14 | |
Физические свойства | ||
| Цвет / внешний вид | Бесцветный [1] | |
| Запах | Без запаха [4] | |
| Точка плавления / замерзания | -210 ° C (-346 ° F) [1] | |
| Температура кипения | -195.795 ° C (-320,431 ° F) [1] | |
| Плотность | 0,001145 г / см 3 [1] | |
| Стандартное / Физическое состояние вещества при нормальной комнатной температуре (твердое тело / жидкость / газ) | Газ [1] | |
| Электропроводность | Неизвестно [3] | |
| Теплопроводность | 0,02583 Wm -1 K -1 [4] | |
Химические свойства | ||
| Воспламеняемость | Невоспламеняющийся [4] | |
| Степени окисления (числа) | 5, 4, 3, 2, -3 [1] | |

Точечная структура азота по Льюису
Атомные данные азота (элемент 14)
| Валентные электроны | 5 [6] | ||||||
| Электронная конфигурация (конфигурация благородного газа) | [He] 2s 2 2p 3 [1] | ||||||
| Атомная структура [3] | |||||||
| - Количество электронов | 7 | ||||||
| - Количество нейтронов | 7 | ||||||
| - Число протонов | 7 | ||||||
| Радиус атома | |||||||
| - Атомный радиус | 1.55 Å [1] | ||||||
| - Ковалентный радиус | 0,71 Å [1] | ||||||
| Электроотрицательность | 3,04 [3] | ||||||
| Заряд ионов | -3 [7] | ||||||
| Энергия ионизации [1] (кДжмоль -1 ) | 1-й | 2-я | 3-й | 4-я | 5-й | 6-й | 7-й |
| 1402.328 | 2856.092 | 4578.156 | 7475.057 | 9444.969 | 53266.97 | 33603,91 | |
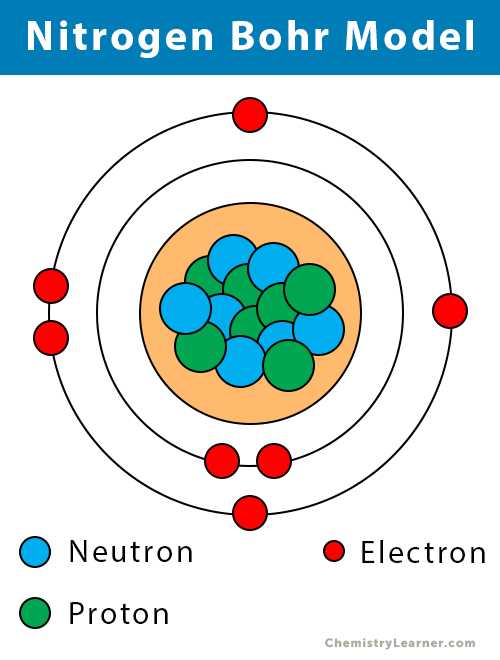
Азотная модель Бора (атомная структура)
Как обычно используется азот
- Шины, заполненные азотом, имеют более стабильное давление, чем шины, заполненные воздухом, что сводит к минимуму возможность утечки [1] .
- Используется при отжиге нержавеющей стали для снижения напряжения и улучшения ее общих функций. [1] .
- Являясь инертным неметаллом, он используется для защиты полупроводниковых устройств, таких как светодиоды и транзисторы [1, 2] .
- Жидкий азот - эффективный криоген, используемый в медицинском распылительном оборудовании для удаления бородавок, доброкачественных опухолей и злокачественных новообразований, а также для лечения других кожных проблем [8] . Он также используется в качестве хладагента для хранения донорских органов, яйцеклеток, спермы и других клеток организма для медицинских целей и научных исследований. Кроме того, он помогает дольше хранить продукты [1] .
- Органический азот является важным химическим компонентом удобрений, нейлона, красителей, азотной кислоты и взрывчатых веществ [1] .
- Сварочные аппараты для азотной пластмассы используются при ремонте пластмассовых деталей автомобилей путем удаления кислорода [9] .
- Азотистый иприт, разновидность иприта, состоящего из азота, используется в качестве химиотерапевтических средств при лечении рака [10] .
Элемент токсичен
Вдыхание большого количества N 2 может привести к удушью, слабости и потере сознания [4] .Глубоководные водолазы склонны к состоянию, называемому наркозом, которое проявляется такими симптомами, как галлюцинации, дезориентация, потеря концентрации и кратковременная потеря памяти в результате повышенного давления азота в крови [11] . Попадание жидкой формы неметалла на кожу и в глаза может вызвать некоторые опасные эффекты, такие как обморожение, боль и ожоги. [4] .

Азот жидкий
Интересные факты
- Это основная составляющая белков и нуклеиновых кислот (ДНК и РНК) в организме большинства живых организмов [4] .
- Во времена египетской цивилизации его получали путем нагревания смеси навоза, соли и мочи [1] .
- Азот иногда называют «дефлогистированным» или «сгоревшим», поскольку, как только весь кислород забирается из воздуха, он состоит только из бывшего [12] .
Стоимость азота
Так как он продается в виде баллонов, стандартный 50-литровый будет стоить вам около 150 долларов, в то время как цена жидкого азота колеблется где-то в пределах 0 долларов.50 и 0,60 доллара за галлон.
Список литературы
- http://www.rsc.org/periodic-table/element/7/nitrogen
- https://education.jlab.org/itselemental/ele007.html
- https://www.chemicool.com/elements/nitrogen.html
- https://pubchem.ncbi.nlm.nih.gov/compound/Nitrogen#section=Top
- https://hobart.k12.in.us/ksms/PeriodicTable/nitrogen.htm
- https://chem.libretexts.org/Textbook_Maps/Inorganic_Chemistry/Supplemental_Modules_(Inorganic_Chemistry)/Descriptive_Chemistry/Elements_Organized_by_Block/2_p-Block_Elements/Group_15%3Chemistry_TheFilm_Elements/Group_15%3_DHM_S_D_Group_15%3_A_D_S_M_Group_15%
- https: // opencurriculum.org / 9436 / химические-свойства-азота /
- https://www.aafp.org/afp/2004/0515/p2365.html
- https://rts.i-car.com/collision-repair-news/nitrogen-hot-air-welding.html
- http://cutaneouslymphoma.stanford.edu/community/mustargen.html
- https://www.oughttco.com/what-is-nitrogen-narcosis-2963052
- https://www.oughttco.com/nitrogen-facts-606568
о соединениях, содержащих азот
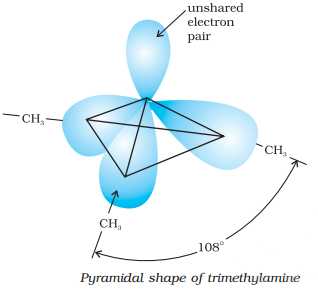
Амины
Структура аминов : Тригонально-пирамидальная
Основность аминов
a) Алифатический амин:
Основная прочность: NH 3
2 2 NH 3 N, b) Ароматический амин :
Основная прочность: NH 3 > Ar- NH 2 > Ar 2 - NH 2
Бензольное кольцо уменьшает электронную плотность над атомом N из-за эффекта резонанса.
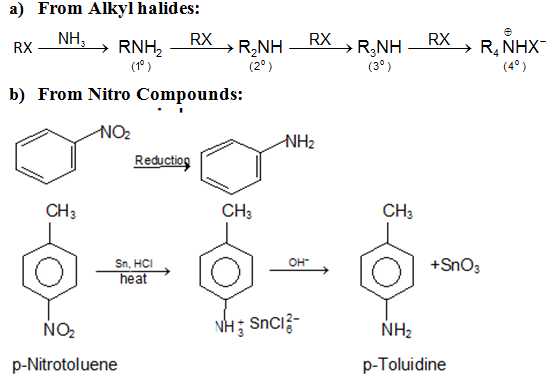
Получение аминов
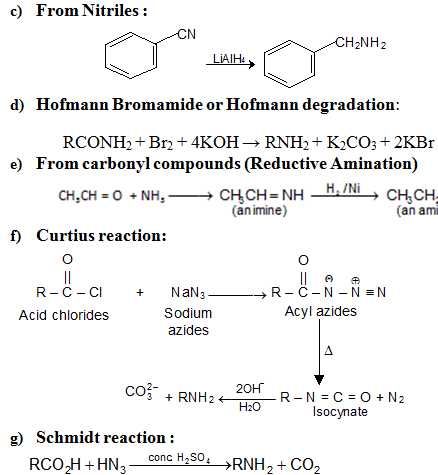

Химические реакции
a) Ацилирование:
RNH 2 + R'COCl → R'CO NHR N-замещенный амид
R 2 NH + R'COCl → R'CO.NR 2 N, N двузамещенный амид
б) Бензоилирование (реакция Шоттена Баумана)
Первичный амин реагирует с бензоилхлоридом с образованием ацилированного продукта
c) Реакция карбиламина (дается только первичными аминами):
C 2 H 5 NH 2 + CHCl 3 + 3KOH → C 2 H 5 NC + 3KCl + 3H 2 O
C 6 H 5 NH 2 + CHCl 3 + 3KOH → C 6 H 5 NC + 3KCl + 3H 2 O
d) Действие с альдегидом и кетоном:
e) Реакция горчичного масла Hofmann:
f) Реакция с карбонилхлоридом: C 2 H 5 - NH 2 + COCl 2 → C 2 H 5 NCO + 2HCl
г) Удаление Гофмана: Когда гидроксид четвертичного аммония сильно нагревается (125 ° или выше), он разлагается с образованием воды, третичного амина и алкена
ч) Диазониевые соли аминов:
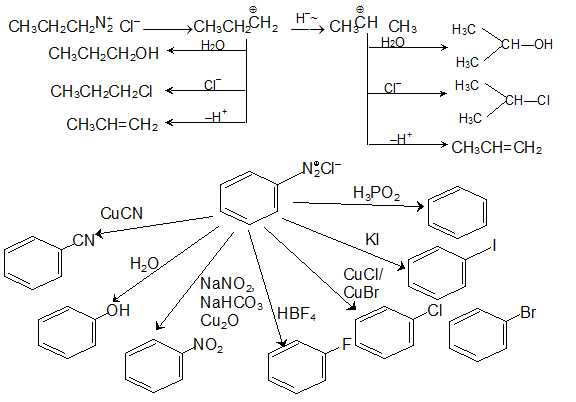
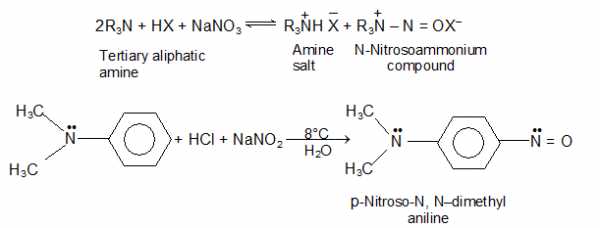
i) Реакция третичных аминов с азотистой кислотой: Когда третичный алифатический амин смешивают с азотистой кислотой, устанавливается равновесие между третичным амином, его солью и соединением N-нитрозоаммония.
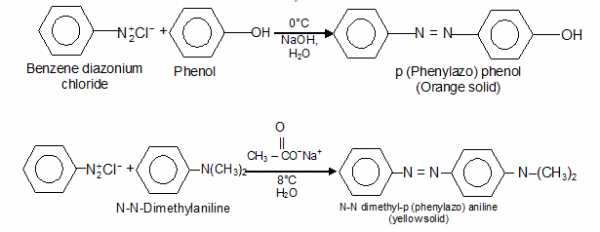
j) Реакции сочетания ареновых солей диазония:
k) Замещение кольца в ароматических аминах:
л) Анилин -X перегруппировка:
Такие соединения не очень стабильны, поэтому группа X мигрирует в основном в p-положении.1.Перегруппировка Фишера-Хеппа
2. Фенилгидроксиламин - п-аминофенольная перегруппировка.
Разделение смеси аминов:
a) Метод Хинсберга
Первичный амин: RNH 2 + C 6 H 5 SO 2 Cl ¾® C 6 H 5 - SO 2 - NH - R + HCl
C 6 H 5 - SO 2 - NH - R: N-алкилбензолсульфонамиды
Растворяется в NaOH из-за кислотной H-присоединения к азоту)
Вторичный амин
Третичный амин: Третичные амины не вступают в реакцию с реагентом Хинсберга.
a) Метод Хофмана:
Смесь аминов обрабатывают диэтилоксалатом, который образует твердый оксамид с первичным амином, сложный эфир жидкого оксима с вторичным амином. Третичный амин не реагирует.
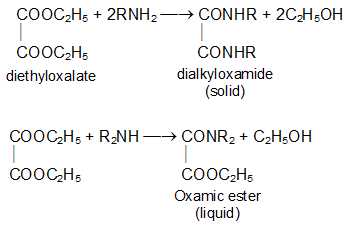
Тест на амины
Первичный амин обрабатывают сильным основанием в присутствии хлороформа, образуется изоцианид, и образовавшийся таким образом изоцианид имеет очень неприятный запах.
Вторичный амин превращается в нитрозоамин путем обработки амина азотистой кислотой. Полученные растворы нагревают фенолом и концентрируют H 2 SO 4 , образуется коричневый или красный цвет, сначала он меняется на синий, а затем на зеленый. Цвет меняется на красный при разбавлении и далее на зеленовато-синий при обработке щелочью.
Третичные ариламины реагируют с азотистой кислотой с образованием о-нитрозоароматического соединения
Особенности курса
- 728 Видео-лекции
- Примечания к редакции
- Документы за предыдущий год
- Интеллектуальная карта
- Планировщик учебы
- Решения NCERT
- Обсуждение Форум
- Тестовая бумага с видео-решением
.
Фактов об азоте - элемент номер 7 или N
Азот - седьмой элемент периодической таблицы. Эти факты об азоте содержат химические и физические данные, а также общую информацию и историю.
 Плитка периодической таблицы азота
Плитка периодической таблицы азота Основные факты об азоте
Имя: Азот
Атомный номер: 7
Символ элемента: N
2 Период: 150007
Блок: p
Семейство элементов: неметалл
Атомная масса: [14.006 43; 14.007 28] Рекомендации ИЮПАК. Для единственного значения используйте 14.0067.
Электронная конфигурация: [He] 2s 2 2p 3 (сокращенно) или 1s 2 2s 2 2p 3 (полный)
Discovery: Дэниел Резерфорд в 1772 году
Учитель Резерфорда Шотландский химик Джозеф Блэк работал над химией воздуха. Когда он удалил кислород путем сжигания фосфора. Он обнаружил, что бензин еще остался. Эта загадка была оставлена в качестве упражнения для его ученика.Резерфорд продолжил удаление диоксида углерода из воздуха и показал, что оставшийся газ не поддерживает жизнь или дальнейшее горение. Он обнаружил, что оставшийся воздух не растворяется в воде и растворах щелочей. Он назвал свой воздух «ядовитым воздухом».
Название Происхождение: Название азота происходит от греческих слов nitron и гена , означающих селитру и образование соответственно. В 1790 году французский химик Жан-Антуан-Клод Шапталь заметил, что этот газ является частью вещества селитры (нитрата калия).Французский химик Антуан Лавуазье назвал газ азотом от греческого слова азотос, что означает безжизненный. Некоторые страны до сих пор используют название Азот для обозначения общего азота.
Изотопы:
Природный азот состоит из двух стабильных изотопов: N-14 и N-15. Четырнадцать других изотопов были произведены в лабораторных условиях в диапазоне от N-10 до N-25.
14 N
Азот-14 - стабильный изотоп, содержащий 7 нейтронов. 99,636% природного азота составляет азот-14.
15 N
Азот-15 - стабильный изотоп, содержащий 8 нейтронов. 0,364% природного азота составляет азот-11.
 Жидкий азот льется из дьюара. Кредит: Кори Доктороу
Жидкий азот льется из дьюара. Кредит: Кори Доктороу Физические данные
Плотность: 0,001145 г / см 3
Точка плавления: 63,2 К (-210,0 ºC или -346,0 ºF)
Точка кипения: 77,355 K -195,795 ºC или -320,431 ºF)
Тройная точка: 63.151 K при 12,52 кПа
Критическая точка: 126,192 K при 3,3958 МПа
Состояние при 20ºC: Газ
Теплота плавления: 0,72 кДж / моль для N 2
Тепло испарения9000 5,56 кДж / моль для N 2
Молярная теплоемкость: 29,124 Дж / моль · К для N 2
 Электронная конфигурация атома азота.
Электронная конфигурация атома азота. Атомные данные
Атомный радиус: 1.55 Å
Ковалентный радиус: 0,71 Å
Ван-дер-Ваальсовый радиус: 1,55 Å
Сродство к электрону: нестабильно
Электроотрицательность: (шкала Полинга)
 Энергия ионизации: 1402,328 кДж / моль
Энергия ионизации: 1402,328 кДж / моль 2 nd Энергия ионизации: 2856,092 кДж / моль
3 rd Энергия ионизации: 4578,156 кДж / моль
4 энергия Ионизация: 4 энергия .057 кДж / моль
5 th Энергия ионизации: 9444,969 кДж / моль
6 th Энергия ионизации: 53266,835 кДж / моль
7 th Энергия ионизации: 643,16
Степени окисления: +5, +3, -3 (обычное), +4, +2, +1, -1, -2 (необычное)
 Естественная цветная фотография самого большого спутника Сатурна, Титана. Снято зондом «Кассини» во время пролета Сатурна в 2005 г. Фото: NASA / JPL
Естественная цветная фотография самого большого спутника Сатурна, Титана. Снято зондом «Кассини» во время пролета Сатурна в 2005 г. Фото: NASA / JPL Интересные факты о азоте
- Азот - это бесцветный газ без вкуса и запаха.
- Азот не встречается в природе как отдельный элемент. Он связывается с собой, образуя двухатомное соединение N 2 .
- Газообразный азот составляет 78% нашей атмосферы.
- Приблизительно 49 миллионов тонн азота удаляются из атмосферы для производства аммиака.
- Группа 15 в таблице Менделеева также известна как семейство азота. Более старое название группы - пниктогены. Пниктоген происходит от греческого слова pnikta , что означает «задыхаться».
- Азот используется для защиты товаров от кислорода.«Воздух» в вашем пакете для картофельных чипсов состоит в основном из азота.
- Примерно 3% вашего веса составляет азот. Это также четвертый по распространенности элемент в организме человека после кислорода, углерода и водорода.
- Азот - ключевой компонент аминокислот. Азот есть в каждой части вашей ДНК.
- Газообразный азот относительно инертен. Почвенные бактерии могут «фиксировать» азот в формах, которые растения используют для роста.
- Азот отвечает за яркие оранжево-красные, сине-зеленые, сине-фиолетовые и темно-фиолетовые цвета северного сияния.
- Титан, спутник Сатурна, имеет плотную атмосферу, почти полностью состоящую из азота и азотных соединений. Желто-оранжевая дымка (см. Рисунок) вызвана взвешенным в атмосфере углеводородным смогом.
Узнайте больше об элементах периодической таблицы Менделеева.
Связанные должности
.| Расшифровка: Химия в ее элементе: азот(Promo) Вы слушаете Химию в ее стихии, представленную вам журналом Chemistry World , журналом Королевского химического общества. (Окончание акции) Крис Смит Здравствуйте! На этой неделе мы взрываем подушки безопасности, удушаем животных и разбираемся с порохом, потому что химик из Кембриджа Питер Уотерс исследует историю азота. Peter Wothers Газообразный азот составляет около 80% воздуха, которым мы дышим. Это, безусловно, самый распространенный элемент в своей группе в периодической таблице, и все же это последний член своего семейства, который был обнаружен. Другие элементы в этой группе, фосфор, мышьяк, сурьма и висмут, были открыты, использовались и злоупотребляли по крайней мере за 100 лет до того, как стало известно об азоте. На самом деле только в 18 - годах люди сосредоточили свое внимание на химии воздуха и свойствах подготовки различных газов.Мы можем по-настоящему понять открытие азота, только отметив открытие некоторых из этих других газов. Роберт Бойль заметил в 1670 году, что при добавлении кислоты в железные опилки смесь становилась очень горячей и изрыгала обильные и вонючие пары. Он был настолько легковоспламеняем, что при приближении к нему зажженной свечи легко загорался и вспыхивал голубоватым и несколько зеленоватым пламенем. Примерно 100 лет спустя гениальный, но замкнутый ученый-миллионер Генри Кавендиш подготовил и собрал водород более тщательно.Кавендиш назвал легковоспламеняющийся воздух из металлов в знак признания этого поразительного свойства. Он также изучал известный нам газ, называемый диоксидом углерода, который впервые был получен шотландским химиком Джозефом Блэком в 1750-х годах. Черный назывался фиксированным воздухом двуокиси углерода, поскольку считалось, что он заблокирован или зафиксирован в определенных минералах, таких как известняк. Его можно было освободить из каменной тюрьмы под действием тепла или кислот. Углекислый газ был также известен под названием «mephitic air», слово «mephitic» означает ядовитый или ядовитый.Это название, очевидно, произошло от его свойства разрушать жизнь, так как оно быстро задыхает всех животных, погруженных в него. Здесь начинается путаница с газообразным азотом, поскольку чистый газообразный азот также удушает животных. Если кислород в замкнутом количестве воздуха израсходован, либо за счет горения в нем свечи, либо из-за содержания животного, большая часть кислорода превращается в газообразный диоксид углерода, который смешивается с газообразным азотом, присутствующим в воздухе. Эта ядовитая смесь больше не поддерживает жизнь и поэтому была названа мефитической. Решающим экспериментом в открытии азота стало осознание того, что в этом ядовитом воздухе есть по крайней мере два различных вида удушающих газов. Это было сделано путем пропускания смеси газов через раствор щелочи, который поглотил диоксид углерода, но оставил после себя газообразный азот. Таким образом Кавендиш приготовил газообразный азот. Он пропускал воздух взад и вперед над нагретым древесным углем, который превращал кислород воздуха в двуокись углерода. Затем диоксид углерода растворяли в щелочи, оставив после себя инертный газообразный азот, который, как он правильно заметил, был немного менее плотным, чем обычный воздух.К сожалению, Кавендиш не опубликовал свои выводы. Он просто сообщил их в письме своему коллеге-ученому Джозефу Пристли, одному из первооткрывателей газообразного кислорода. Следовательно, открытие азота обычно приписывается одному из учеников Джозефа Блэка, шотландскому ученому Дэниелу Резерфорду, который также является дядей писателя и поэта сэра Вальтера Скотта. Резерфорд опубликовал свои открытия, похожие на те, что сделал Кавендиш в его докторской диссертации, озаглавленной «Инаугурационная диссертация в эфире, названная фиксированным или зловонным» в 1772 году. Так что насчет названия, азот? В конце 1780-х годов химическая номенклатура претерпела крупную революцию под руководством французского химика Антуана Лавуазье. Именно он и его коллеги предложили многие из названий, которые мы все еще используем сегодня, в том числе слово водород, которое происходит от греческого, означающего образование воды, и кислород от греческого для производителя кислоты, поскольку Лавуазье ошибочно полагал, что кислород является ключевым компонентом образования кислоты. все кислоты. Однако в свой список известных тогда элементов Лавуазье включил термин азот или азотный газ для того, что мы сейчас называем азотом.Это опять-таки происходит от греческих слов, на этот раз означающих отсутствие жизни, опять-таки акцентируя внимание на ее возбудимости. Незадолго до этого было отмечено, что существует множество анаэробных газов, фактически никакой другой газ, кроме кислорода, не может поддерживать жизнь. Поэтому название азот было предложено из наблюдения, опять же впервые сделанного Кавендишем, что если газы воспламеняются кислородом, а затем образующиеся газы диоксида азота проходят через щелочь, образуется селитра, иначе известная как селитра или нитрат калия.Слово азот, следовательно, означает нитрообразователь. Производные от слова азот сохранились до сих пор. Компаунд, используемый для взрывного наполнения газом автомобильных подушек безопасности, представляет собой азид натрия, соединение только натрия и азота. При срабатывании это соединение взрывно разлагается, высвобождая газообразный азот, который надувает мешки. Это азотное соединение не только не уничтожило жизнь, но и спасло тысячи людей. Крис Смит Питер Уотерс из Кембриджского университета рассказывает историю открытия азота.В следующий раз, когда мы расскажем о химии в ее стихии, о том, как химики вроде Менделеева разобрались как с известным, так и с неизвестным. Марк Пеплоу Пока другие ученые пытались создать способы упорядочения известных элементов, Менделеев создал систему, которая могла предсказать существование элементов, которые еще не были обнаружены. Когда он представил эту таблицу миру в 1869 году, в ней было четыре заметных пробела. Один из них был чуть ниже марганца, и Менделеев предсказал, что будет найден элемент с атомным весом 43, чтобы заполнить этот пробел, но только в 1937 году группа итальянских ученых наконец нашла недостающий элемент, который они назвали технецием. Крис Смит И вы можете услышать, как Марк Пеплоу рассказывает историю технеция в выпуске «Химии в ее стихии» на следующей неделе. Я Крис Смит, спасибо за внимание. Увидимся в следующий раз. (Промо) (Окончание промо) |