Какой продукт содержит углерод водород и кислород имеет сладкий вкус
Вариант 4 (с. 19 – 23) | Волжский класс
Ответы к стр. 19 – 23
1. Прочитай текст.
Сахар — это сладкий на вкус пищевой продукт. Он входит с состав мороженого, конфет и фруктовых вод. Кристаллы сахара мы добавляем в кашу, кофе или чай. Сахар снабжает наш организм энергией, причём быстрее, чем любая другая пища. Но надо помнить, что неумеренное употребление сахара может привести к разрушению зубов.
Сахар содержит углерод, водород и кислород. Различное сочетание групп атомов образуют различные виды сахара. Сахар, который мы употребляем в пищу, называют сахарозой.
Любое зелёное растение производит сахар. Тот сахар, который мы используем в пищу, получают из двух растений: сахарного тростника и сахарной свёклы. Сахарный тростник – это разновидность гигантской травы. Сахарная свёкла – это овощ, толстый корень которого богат сахаром.
(106 слов)
(По материалам энциклопедии “Хочу всё знать”)
2. Какова тема текста?
О сахаре.
3. Определи стиль текста: научный, художественный или публицистический.
Научный.
4. Заполни таблицу.
| Вопрос | Ответ |
| Какой продукт, содержащий углерод и кислород, имеет сладкий вкус? | Сладкий продукт, содержащий углерод и кислород, — сахар. |
| Что образует сочетание групп атомов? | Различное сочетание групп атомов образуют различные виды сахара. |
| Чем сахар «снабжает» наш организм? | Сахар снабжает наш организм энергией. |
5. Вставь слова из текста так, чтобы предложения имели смысл.
Любое зелёное растение производит сахар.
Сахар, употребляемый нами в пищу, называют сахарозой.
6. Подберите и запишите к словам антонимы.
быстрее — медленнее
богатый — бедный, нищий
разрушить — создать
добавить — убавить, уменьшить
толстый — тонкий, худой
дать — взять, забрать
7. Вставь пропущенные буквы. Выпиши второе и пятое предложения. Подчеркни в них грамматические основы.
Наступила в есна. Колхозники засеяли поля семенами свёклы. Вскоре появились зелёные ростки. Всё лето люди ухаживали за растениями. Осенью они собрали богатый урожай свёклы. Много получится сахару!
Колхозники засеяли поля семенами свёклы. Осенью они собрали богатый урожай свёклы.
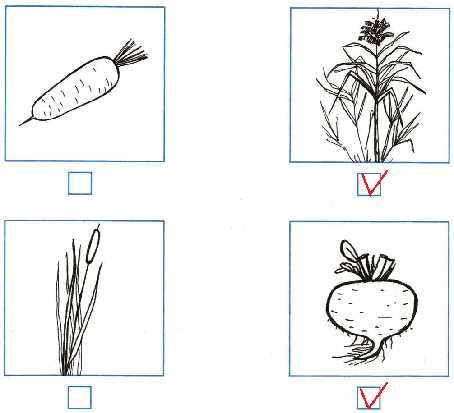
8. Отметь рисунки с изображениями растений, из которых получают сахар.
9. Образуй и запиши из данных слов словосочетания прилагательное + существительное.
гигант, трава — гигантская трава
сахар, пудра — сахарная пудра
сладость, каша — сладкая каша
фрукт, мороженое — фруктовое мороженое
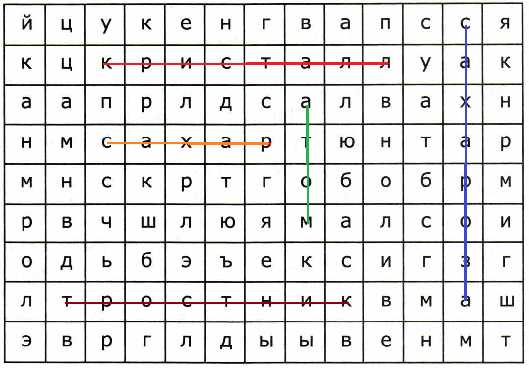
10. Найди и выдели в таблице слова: кристалл, сахар, сахароза, тростник, атом.
Ответы к заданиям. Крылова О. Н. Чтение. Работа с текстом. 4 класс
4.7 / 5 ( 1090 голосов )
Водородная связь - Chemistry LibreTexts
Водородная связь - это межмолекулярная сила (IMF), которая формирует особый тип диполь-дипольного притяжения, когда атом водорода, связанный с сильно электроотрицательным атомом, существует рядом с другим электроотрицательным атомом с неподеленной парой. электронов. Между молекулами возникают межмолекулярные силы (ММП). Другие примеры включают обычные диполь-дипольные взаимодействия и дисперсионные силы. Водородные связи обычно сильнее обычных диполь-дипольных и дисперсионных сил, но слабее, чем истинные ковалентные и ионные связи.
Доказательства водородной связи
Многие элементы образуют соединения с водородом. Если вы нанесете на график точки кипения соединений элементов группы 14 с водородом, вы обнаружите, что точки кипения увеличиваются по мере того, как вы спускаетесь по группе.
Рисунок 1: Температуры кипения элементарных галогенидов 14 группы.Повышение температуры кипения происходит из-за того, что молекулы становятся больше с увеличением количества электронов, и поэтому дисперсионные силы Ван-дер-Ваальса становятся больше. Если вы повторите это упражнение с соединениями элементов групп 15, 16 и 17 с водородом, произойдет нечто странное.
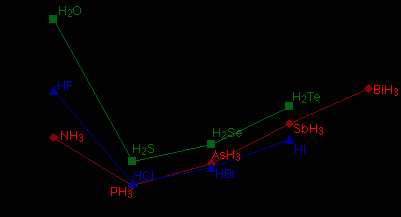 Рис. 2: Температуры кипения галогенидов элементов 15-17 группы.
Рис. 2: Температуры кипения галогенидов элементов 15-17 группы. Хотя те же рассуждения применимы к группе 4 Периодической таблицы Менделеева, точка кипения соединения водорода с первым элементом в каждой группе аномально высока. В случаях \ (NH_3 \), \ (H_2O \) и \ (HF \) должны быть некоторые дополнительные межмолекулярные силы притяжения, требующие значительно больше тепловой энергии для разрушения IMFs. Эти относительно мощные межмолекулярные силы описываются как водородные связи.
Происхождение водородных связей
К молекулам, способным образовывать водородные связи, относятся следующие:
Рисунок 3: Неподеленные пары, ответственные за водородные связи в \ (NH_3 \), \ (H_2O \) и \ (HF \). Сплошная линия представляет собой связь в плоскости экрана или бумаги. Пунктирные связи возвращаются в экран или бумагу от вас, а клиновидные выходят к вам.Обратите внимание, что в каждой из этих молекул:
- Водород присоединяется непосредственно к сильно электроотрицательным атомам, в результате чего водород приобретает очень положительный заряд.
- Каждый из сильно электроотрицательных атомов достигает высокого отрицательного заряда и имеет по крайней мере одну «активную» неподеленную пару. У неподеленных пар на 2-м уровне электроны содержатся в относительно небольшом объеме пространства, что приводит к высокой плотности отрицательного заряда. Одинокие пары на более высоких уровнях более диффузны, что приводит к более низкой плотности заряда и меньшему сродству к положительному заряду.
Если вы не знакомы с электроотрицательностью, вам следует перейти по этой ссылке, прежде чем продолжить.+ \) водород настолько сильно притягивается к неподеленной паре, что это почти как если бы вы начинали образовывать координационную (дательную ковалентную) связь. Это не заходит так далеко, но притяжение значительно сильнее, чем обычное диполь-дипольное взаимодействие. Водородные связи имеют примерно одну десятую прочности средней ковалентной связи и постоянно разрушаются и преобразовываются в жидкой воде. Если вы уподобите ковалентную связь между кислородом и водородом стабильному браку, водородная связь имеет статус «просто хороших друзей».+ \) атомы водорода и неподеленные пары для каждого из них, участвующего в водородных связях.
Вот почему температура кипения воды выше, чем у аммиака или фтороводорода. В случае аммиака количество водородных связей ограничено тем фактом, что каждый азот имеет только одну неподеленную пару. В группе молекул аммиака недостаточно неподеленных пар, чтобы удовлетворить все водороды. Во фтористом водороде проблема заключается в нехватке водорода. В воде две водородные связи и две неподеленные пары позволяют образовывать взаимодействия водородных связей в решетке молекул воды.Таким образом, вода считается идеальной системой с водородными связями.
Более сложные примеры водородной связи
Гидратация отрицательных ионов
Когда ионное вещество растворяется в воде, молекулы воды группируются вокруг разделенных ионов. Этот процесс называется гидратацией. Вода часто присоединяется к положительным ионам посредством координационных (дативных ковалентных) связей. Он связывается с отрицательными ионами с помощью водородных связей.
Если вас интересует связывание в гидратированных положительных ионах, вы можете перейти по этой ссылке, чтобы скоординировать (дательный ковалентный) связывание.
На диаграмме показаны потенциальные водородные связи, образованные с ионом хлорида Cl-. Хотя неподеленные пары в ионе хлорида находятся на трехуровневом уровне и обычно не будут достаточно активными для образования водородных связей, в этом случае они становятся более привлекательными за счет полного отрицательного заряда хлора.
Рис. 5: Водородная связь между хлорид-ионами и водой.
Каким бы сложным ни был отрицательный ион, всегда будут неподеленные пары, с которыми атомы водорода из молекул воды могут связывать водородные связи.
Водородная связь в спиртах
Спирт - это органическая молекула, содержащая группу -ОН. Любая молекула, которая имеет атом водорода, присоединенный непосредственно к кислороду или азоту, способна образовывать водородные связи. Водородные связи также возникают, когда водород связан с фтором, но группа HF не появляется в других молекулах. Молекулы с водородными связями всегда будут иметь более высокие температуры кипения, чем молекулы аналогичного размера, которые не имеют группы -O-H или -N-H. Водородная связь делает молекулы «более липкими», поэтому для их разделения требуется больше тепла (энергии).Это явление можно использовать для анализа температуры кипения различных молекул, определяемой как температура, при которой происходит фазовый переход от жидкости к газу.
Этанол, \ (\ ce {Ch4Ch3-O-H} \), и метоксиметан, \ (\ ce {Ch4-O-Ch4} \), оба имеют одну и ту же молекулярную формулу \ (\ ce {C2H6O} \).
У них одинаковое количество электронов и одинаковая длина. Притяжения Ван-дер-Ваальса (как дисперсионные силы, так и диполь-дипольные притяжения) в каждом из них будут одинаковыми. Однако этанол имеет атом водорода, присоединенный непосредственно к кислороду; здесь кислород по-прежнему имеет две неподеленные пары, как молекула воды.Между молекулами этанола может происходить водородная связь, хотя и не так эффективно, как в воде. Водородная связь ограничена тем фактом, что в каждой молекуле этанола есть только один водород с достаточным зарядом +.
В метоксиметане неподеленные пары на кислороде все еще присутствуют, но атомов водорода недостаточно для образования водородных связей. За исключением некоторых довольно необычных случаев, атом водорода должен быть присоединен непосредственно к очень электроотрицательному элементу, чтобы возникла водородная связь.Температуры кипения этанола и метоксиметана демонстрируют драматический эффект, который водородная связь оказывает на липкость молекул этанола:
этанол (с водородными связями) 78,5 ° С метоксиметан (без водородных связей) -24,8 ° С Водородные связи в этаноле подняли его точку кипения примерно на 100 ° C. Важно понимать, что водородные связи существуют в дополнение к притяжению Ван-дер-Ваальса.Например, все следующие молекулы содержат одинаковое количество электронов, а первые две имеют одинаковую длину цепи. Более высокая температура кипения бутан-1-ола обусловлена дополнительной водородной связью.
При сравнении двух спиртов (содержащих группы -ОН), обе точки кипения высоки из-за дополнительных водородных связей; однако значения не совпадают. Температура кипения 2-метилпропан-1-ола не такая высокая, как у бутан-1-ола, потому что разветвление в молекуле делает ван-дер-ваальсовое притяжение менее эффективным, чем у более длинного бутан-1-ола.
Водородная связь в органических молекулах, содержащих азот
Водородная связь также возникает в органических молекулах, содержащих группы N-H; вспомните водородные связи, возникающие с аммиаком. Примеры варьируются от простых молекул, таких как CH 3 NH 2 (метиламин), до больших молекул, таких как белки и ДНК. Две нити знаменитой двойной спирали в ДНК удерживаются вместе водородными связями между атомами водорода, присоединенными к азоту на одной нити, и неподеленными парами на другой азоте или кислородом на другой.
Доноры и акцепторы
Чтобы возникла водородная связь, должны присутствовать как донор водорода, так и акцептор. Донор в водородной связи обычно представляет собой сильно электроотрицательный атом, такой как N, O или F, который ковалентно связан с водородной связью.
Акцептор водорода - это электроотрицательный атом соседней молекулы или иона, который содержит неподеленную пару, которая участвует в водородной связи.
Почему возникает водородная связь?
Поскольку донор водорода (N, O или F) сильно электроотрицателен, он притягивает ковалентно связанную электронную пару ближе к своему ядру и от атома водорода.Затем атом водорода остается с частичным положительным зарядом, создавая диполь-дипольное притяжение между атомом водорода, связанным с донором, и неподеленной электронной парой акцептора. Это приводит к водородной связи (см. Взаимодействие между молекулами с постоянными диполями)
Типы водородных связей
Хотя водородные связи хорошо известны как тип IMF, эти связи также могут возникать внутри одной молекулы, между двумя идентичными молекулами или между двумя разнородными молекулами.
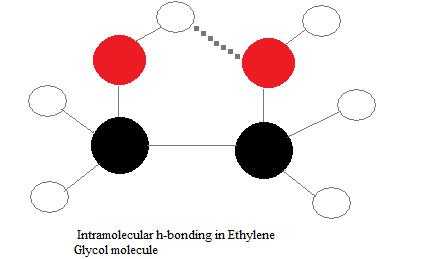
Внутримолекулярные водородные связи
Внутримолекулярные водородные связи - это те, которые встречаются в пределах одной единственной молекулы. Это происходит, когда две функциональные группы молекулы могут образовывать водородные связи друг с другом. Для того, чтобы это произошло, как донор водорода, так и акцептор водорода должны присутствовать в одной молекуле, и они должны находиться в непосредственной близости друг от друга в молекуле. Например, внутримолекулярная водородная связь происходит в этиленгликоле (C 2 H 4 (OH) 2 ) между двумя его гидроксильными группами из-за геометрии молекулы.
Межмолекулярные водородные связи
Межмолекулярные водородные связи возникают между отдельными молекулами вещества. Они могут возникать между любым количеством подобных или непохожих молекул, пока доноры и акцепторы водорода присутствуют в положениях, где они могут взаимодействовать друг с другом. Например, межмолекулярные водородные связи могут возникать только между молекулами NH 3 , только между молекулами H 2 O или между молекулами NH 3 и H 2 O.
Свойства и эффекты водородных связей
по температуре кипения
Когда мы рассматриваем точки кипения молекул, мы обычно ожидаем, что молекулы с большей молярной массой будут иметь более высокие нормальные точки кипения, чем молекулы с меньшей молярной массой. Это, без учета водородных связей, связано с большими дисперсионными силами (см. «Взаимодействие между неполярными молекулами»). Более крупные молекулы имеют больше места для распределения электронов и, следовательно, больше возможностей для мгновенного дипольного момента.Однако, когда мы рассматриваем приведенную ниже таблицу, мы видим, что это не всегда так.
Соединение Молярная масса Нормальная точка кипения \ (H_2O \) 18 г / моль 373 К \ (HF \) 20 г / моль 292,5 К \ (NH_3 \) 17 г / моль 239.8 К \ (H_2S \) 34 г / моль 212,9 К \ (HCl \) 36,4 г / моль 197,9 К \ (PH_3 \) 34 г / моль 185,2 К Мы видим, что H 2 O, HF и NH 3 имеют более высокие температуры кипения, чем такое же соединение, образованное между водородом и следующим элементом, движущимся вниз по соответствующей группе, что указывает на то, что первые имеют более высокие межмолекулярные силы. .Это связано с тем, что все H 2 O, HF и NH 3 обладают водородными связями, тогда как другие - нет. Кроме того, \ (H_2O \) имеет меньшую молярную массу, чем HF, но участвует в большем количестве водородных связей на молекулу, поэтому его температура кипения выше.
по вязкости
То же влияние, которое наблюдается в отношении температуры кипения в результате образования водородных связей, также может наблюдаться в вязкости некоторых веществ. Вещества, способные образовывать водородные связи, как правило, имеют более высокую вязкость, чем те, которые не образуют водородные связи.Как правило, вещества, которые могут иметь множественные водородные связи, обладают еще более высокой вязкостью.
Факторы, препятствующие образованию водородных связей
Электроотрицательность
Водородная связь не может происходить без существенной разницы в электроотрицательности водорода и атома, с которым она связана. Таким образом, мы видим такие молекулы, как PH 3 , которые не участвуют в образовании водородных связей. PH 3 демонстрирует треугольную пирамидальную геометрию молекулы, как у аммиака, но в отличие от NH 3 он не может связывать водород.Это происходит из-за сходства электроотрицательностей фосфора и водорода. Оба атома имеют электроотрицательность 2,1, поэтому дипольный момент отсутствует. Это предотвращает получение водородной связью частичного положительного заряда, необходимого для водородной связи с неподеленной электронной парой в другой молекуле. (см. Поляризуемость)
Размер атома
Размер доноров и акцепторов также может влиять на способность к водородной связи. Этим можно объяснить относительно низкую способность Cl образовывать водородные связи.Когда радиусы двух атомов сильно различаются или велики, их ядра не могут достичь близкого расстояния при взаимодействии, что приводит к слабому взаимодействию.
Водородная связь в природе
Водородные связи играют решающую роль во многих биологических процессах и могут объяснять многие природные явления, такие как необычные свойства воды. Помимо присутствия в воде, водородные связи также важны в водной транспортной системе растений, вторичной и третичной структуре белка и спаривании оснований ДНК.
Растения
Теория когезии-адгезии транспорта в сосудистых растениях использует водородные связи для объяснения многих ключевых компонентов движения воды через ксилему растения и другие сосуды. Внутри сосуда молекулы воды связываются водородом не только друг с другом, но и с цепочкой целлюлозы, которая составляет стенку растительных клеток. Поскольку сосуд относительно невелик, притяжение воды к целлюлозной стенке создает своего рода капиллярную трубку, которая допускает капиллярное действие.Этот механизм позволяет растениям втягивать воду в свои корни. Кроме того, водородная связь может создать длинную цепочку молекул воды, которая может преодолеть силу тяжести и подняться на большую высоту над листьями.
Белки
Водородная связь присутствует в большом количестве во вторичной структуре белков, а также в незначительной степени в третичной конформации. Вторичная структура белка включает взаимодействия (в основном водородные связи) между соседними полипептидными цепями, которые содержат пары азот-водородных связей и атомы кислорода.Поскольку как N, так и O являются сильно электроотрицательными, атомы водорода, связанные с азотом в одной цепи полипептида, могут образовывать водородные связи с атомами кислорода в другой цепи и наоборот. Хотя они относительно слабы, эти связи обеспечивают существенную стабильность вторичной белковой структуры, поскольку они повторяются много раз и работают вместе.
В третичной структуре белка взаимодействия в основном происходят между функциональными R-группами полипептидной цепи; одно такое взаимодействие называется гидрофобным взаимодействием.Эти взаимодействия происходят из-за водородных связей между молекулами воды вокруг гидрофоба, которые дополнительно усиливают конформацию белка.
Список литературы
- Браун и др. Химия: центральная наука. 11 изд. Река Аппер Сэдл, Нью-Джерси: Pearson / Prentice Hall, 2008.
- Чанг, Раймонд. Общая химия: основные понятия. 3-е изд. Нью-Йорк: Макгроу Хилл, 2003
- Петруччи и др. Общая химия: принципы и современные приложения.9 изд. Река Аппер Сэдл, Нью-Джерси: Пирсон / Прентис Холл, 2007.
Авторы и авторство
.Компоненты воздуха - кислород, азот, двуокись углерода, водяной пар
9000BSE 9000 Примечания3 2 6 Примечания CBSE
- БЕСПЛАТНАЯ ЗАПИСЬ КЛАСС
- КОНКУРСНЫЕ ЭКЗАМЕНА
- BNAT
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 110003 CBSE
- Книги NCERT
- Книги NCERT для класса 5
- Книги NCERT, класс 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- NCERT Книги для класса 11
- NCERT Книги для класса 12
- NCERT Exemplar
9plar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- RS Aggarwal
- RS Aggarwal Решения класса 12
- RS Aggarwal Class 11 Solutions
- RS Aggarwal Решения класса 10
- Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- RD Sharma
- RD Sharma Class 6 Решения
- RD Sharma Class 7 Решения
- Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- PHYSICS
- Механика
- Оптика
- Термодинамика
- Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Статистика
- 9000 Pro Числа
- Числа
- 9000 Pro Числа Тр Игонометрические функции
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убытки
- Полиномиальные уравнения
- Деление фракций
- Microology
0003000
- FORMULAS
- Математические формулы
- Алгебраные формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
0003000- 000 CALCULATORS
- 000
- 000 Калькуляторы по химии 900 Образцы документов для класса 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 1 1
- Образцы документов CBSE для класса 12
- Вопросники предыдущего года CBSE
- Вопросники предыдущего года CBSE, класс 10
- Вопросники предыдущего года CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Класс 11 Физика
- HC Verma Solutions Класс 12 Физика
- Решения Лакмира Сингха
9000 Класс
- Решения Лахмира Сингха класса 9
- Решения Лахмира Сингха класса 10
- Решения Лакмира Сингха класса 8
Примечания CBSE класса 7 ПримечанияПримечания CBSE класса 8 Примечания CBSE класса 9 Примечания CBSE класса 10 Примечания CBSE класса 11 Примечания 12 CBSE Примечания к редакции 9000 CBSE 9000 Примечания к редакции класса 9 CBSE Примечания к редакции класса 10 CBSE Примечания к редакции класса 11 Примечания к редакции класса 12 CBSE Дополнительные вопросы CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по математике класса 9 CBSE Вопросы
- CBSE Class 10 Дополнительные вопросы по математике
- CBSE Class 10 Science Extra questions
CBSE Class
- Class 3
- Class 4
- Class 5
- Class 6
- Class 7
- Class 8 Класс 9
- Класс 10
- Класс 11
- Класс 12
Учебные решения Решения NCERT .
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия
- Решения NCERT для биологии класса 11
- Решение NCERT s Для класса 11 по математике
- NCERT Solutions Class 11 Accountancy
- NCERT Solutions Class 11 Business Studies
- NCERT Solutions Class 11 Economics
- NCERT Solutions Class 11 Statistics
- NCERT Solutions Class 11 Commerce
- NCERT Solutions for Class 12
- Решения NCERT для физики класса 12
- Решения NCERT для химии класса 12
- Решения NCERT для биологии класса 12
- Решения NCERT для математики класса 12
- Решения NCERT, класс 12, бухгалтерский учет
- Решения NCERT, класс 12, бизнес-исследования
- NCERT Solutions Class 12 Economics
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- NCERT Solut Ионы Для класса 4
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для класса 5
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для класса 6
- Решения NCERT для математики класса 6
- Решения NCERT для науки класса 6
- Решения NCERT для класса 6 по социальным наукам
- Решения NCERT для класса 6 Английский язык
- Решения NCERT для класса 7
- Решения NCERT для математики класса 7
- Решения NCERT для науки класса 7
- Решения NCERT для социальных наук класса 7
- Решения NCERT для класса 7 Английский язык
- Решения NCERT для класса 8
- Решения NCERT для математики класса 8
- Решения NCERT для науки 8 класса
- Решения NCERT для социальных наук 8 класса ce
- Решения NCERT для класса 8 Английский
- Решения NCERT для класса 9
- Решения NCERT для класса 9 по социальным наукам
- Решения NCERT для математики класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для математики класса 9, глава 2
Решения NCERT- для математики класса 9, глава 3
- Решения NCERT для математики класса 9, глава 4
- Решения NCERT для математики класса 9, глава 5
Решения NCERT- для математики класса 9, глава 6
- Решения NCERT для математики класса 9, глава 7
Решения NCERT- для математики класса 9, глава 8
- Решения NCERT для математики класса 9, глава 9
- Решения NCERT для математики класса 9, глава 10
Решения NCERT- для математики класса 9, глава 11
Решения- NCERT для математики класса 9 Глава 12
Решения NCERT- для математики класса 9 Глава 13
- NCER Решения T для математики класса 9 Глава 14
- Решения NCERT для математики класса 9 Глава 15
- Решения NCERT для науки класса 9
- Решения NCERT для науки класса 9 Глава 1
- Решения NCERT для науки класса 9 Глава 2
- Решения NCERT для науки класса 9 Глава 3
- Решения NCERT для науки класса 9 Глава 4
- Решения NCERT для науки класса 9 Глава 5
- Решения NCERT для науки класса 9 Глава 6
- Решения NCERT для науки класса 9 Глава 7
- Решения NCERT для науки класса 9 Глава 8
Производство водорода | Водород
Метод: Электролиз
Вкратце: Процесс, при котором вода (h3O) расщепляется на водород (h3) и кислород (O2) газ с подводом энергии и тепла в случае высокотемпературного электролиза.
На практике: Электрический ток разделяет воду на составные части. Если используется возобновляемая энергия, газ имеет нулевой углеродный след и известен как зеленый водород.Метод: Риформинг - в первую очередь риформинг природного газа, но также и биогаза
Вкратце: Основные способы превращения природного газа, в основном метана, в водород включают реакцию либо с паром (паровой риформинг или паровой риформинг метана, когда используется метан), кислородом (частичное окисление) или с обоими последовательно (автотермический риформинг)
На практике: Паровой риформинг: в качестве окислителя используется чистый водяной пар.Реакция требует введения тепла («эндотермический»).Метод: Водород из других промышленных процессов, которые создают водород в качестве побочного продукта.
Вкратце: Электрохимические процессы, такие как промышленное производство каустической соды и хлора, производят водород как побочный продукт.
На практике: Производство хлора и каустической соды сводится к пропусканию электрического тока через рассол (раствор соли - хлорида натрия - в воде).Рассол диссоциирует и рекомбинирует посредством обмена электронов (доставляемых током) на газообразный хлор, растворенную каустическую соду1 и водород. По характеру химической реакции хлор, каустическая сода и водород всегда производятся в фиксированном соотношении: 1,1 тонны каустика и 0,03 тонны водорода на тонну хлора.риформинг
Паровой риформинг метана (SMR):
Как уже было описано выше, в настоящее время большая часть производимого сегодня водорода производится посредством процесса с интенсивным выбросом CO2, который называется паровым риформингом метана.
Высокотемпературный пар (700–1000 ° C) используется для производства водорода из источника метана, например природного газа. При паровом риформинге метана метан реагирует с паром под давлением 3–25 бар (1 бар = 14,5 фунтов на кв. Дюйм) в присутствии катализатора с образованием водорода, монооксида углерода и относительно небольшого количества диоксида углерода. Паровой риформинг эндотермический , то есть для протекания реакции в процесс необходимо подвести тепло.
Затем в так называемой «реакции конверсии водяного газа» монооксид углерода и водяной пар реагируют с использованием катализатора с образованием диоксида углерода и большего количества водорода.На заключительном этапе процесса, называемом «адсорбция при переменном давлении», диоксид углерода и другие примеси удаляются из газового потока, оставляя практически чистый водород. Паровой риформинг также можно использовать для производства водорода из других видов топлива, таких как этанол, пропан или даже бензин.
Для химиков:
Реакция парового риформинга метана
Ch5 + h3O (+ тепло) → CO + 3h3Реакция конверсии водяного газа
CO + h3O → CO2 + h3 (+ небольшое количество тепла)Частичное окисление
При частичном окислении метан и другие углеводороды в природном газе реагируют с ограниченным количеством кислорода (обычно из воздуха), которого недостаточно для полного окисления углеводородов до диоксида углерода и воды.При доступном количестве кислорода меньше стехиометрического, продукты реакции содержат в основном водород и монооксид углерода (и азот, если реакция проводится с воздухом, а не с чистым кислородом), а также относительно небольшое количество диоксида углерода и других соединений. Впоследствии в реакции конверсии водяного газа монооксид углерода реагирует с водой с образованием диоксида углерода и большего количества водорода.
Частичное окисление - это экзотермический процесс , при котором выделяется тепло.Этот процесс обычно намного быстрее, чем паровой риформинг, и требует меньшего размера реактора. Как видно из химических реакций частичного окисления, в этом процессе первоначально образуется меньше водорода на единицу входящего топлива, чем получается при паровом риформинге того же топлива.Для химиков:
Реакция частичного окисления метана
Ch5 + ½O2 → CO + 2h3 (+ тепло)Реакция конверсии водяного газа
CO + h3O → CO2 + h3 (+ небольшое количество тепла)Источник: энергетика.gov
Паровой риформинг метана (SMR) для биогаза
Процесс SMR можно также использовать для производства водорода из биогаза.Электролиз
Несмотря на то, что водород можно получить множеством способов, наиболее интересной, но и многообещающей частью является получение водорода путем электролиза воды.В этом процессе электролиз расщепляет воду на водород и кислород с помощью электричества.Если используемое электричество поступает из возобновляемых источников энергии, таких как ветер или солнце, а произведенный водород используется в топливных элементах, то весь энергетический процесс не будет создавать чистых выбросов. В данном случае речь идет о «зеленом водороде».
Электролизер состоит из источника постоянного тока и двух электродов с покрытием из благородного металла, разделенных электролитом. Электролит или ионный проводник может быть жидкостью, например проводящим раствором едкого калия (гидроксид калия, КОН) для щелочного электролиза.
В щелочном электролизере катод (отрицательный полюс) теряет электроны в водном растворе.Вода диссоциирует, что приводит к образованию водорода (h3) и гидроксид-ионов (OH -
Носители заряда движутся в электролите к аноду. На аноде (положительный полюс) электроны поглощаются отрицательными анионами OH -. Анионы ОН - окисляются с образованием воды и кислорода. Кислород поднимается на аноде. Мембрана предотвращает смешивание продуктовых газов h3 и O2, но пропускает ионы OH -.Электролизеры состоят из отдельных ячеек и узлов центральной системы (баланс завода). Комбинируя электролитические ячейки и батареи, производство водорода можно адаптировать к индивидуальным потребностям.Электролизеры различаются по материалам электролита и температуре, при которой они работают: низкотемпературный электролиз (LTE), включая щелочной электролиз (AE) , электролиз с протонообменной мембраной (PEM ) и анионообменная мембрана ( AEM) электролиз (также известный как щелочной PEM) и высокотемпературный электролиз (HTE).Последняя группа, в первую очередь, включает электролиз твердого оксида (SOE ), но он все еще находится на продвинутой стадии исследований и разработок, и продукты еще не коммерчески доступны. Ожидается, что по достижении рыночной зрелости его преимущества будут включать повышенную эффективность преобразования и возможность производства синтез-газа непосредственно из пара и CO 2 для использования в различных приложениях, таких как синтетическое жидкое топливо (E4tech 2014, IEA 2015b).
Высокотемпературный электролиз особенно интересен, когда рядом с электролизером есть источник тепла (как это часто бывает на промышленных предприятиях или), более экономически эффективен, чем традиционный электролиз при комнатной температуре.Действительно, часть энергии поставляется в виде тепла, которое либо бесплатно, либо дешевле, чем электричество, а также потому, что реакция электролиза более эффективна при более высоких температурах.
Выбор той или иной технологии электролиза зависит от потребностей использования и местных условий.Водород похож на электричество в том смысле, что его использование не вызывает никаких выбросов. Его углеродный след связан с его производственным режимом. В случае водорода, полученного путем электролиза, его углеродный след водорода напрямую связан с источником электричества.Таким образом, водород, производимый из безуглеродных возобновляемых источников или атомной энергии, не содержит углерода. Водород, произведенный с помощью сетки, имеет ту же углеродную интенсивность, что и смесь сетки.
Водород как побочный продукт
Как объяснено выше, водород получают путем отделения от его соединения.
Если производство водорода может быть первой целью процесса разделения, то также может быть, что процесс разделения направлен в первую очередь на производство другой молекулы и получение водорода в качестве побочного продукта.
Производство хлора и каустической соды сводится к пропусканию электрического тока через рассол (раствор соли - хлорида натрия - в воде). Рассол диссоциирует и рекомбинирует посредством обмена электронов (доставляемых током) на газообразный хлор, растворенную каустическую соду и водород. По характеру химической реакции хлор, каустическая сода и водород всегда производятся в фиксированном соотношении: 1,1 тонны каустика и 0,03 тонны водорода на тонну хлора.
Ряд исследований был направлен на определение количества доступного промышленного остаточного водорода.В рамках проекта ЕС «Дороги 2 HyCom» (Maisonnier et al. 2007) среди прочих результатов была получена карта, показывающая места производства водорода в Европе. На этой карте источники водорода разбиты на три категории: категория «коммерсант» поставляет водород другим промышленным потребителям, а категория «зависимая» сохраняет водород на месте для собственного использования. Только «побочный продукт» водород больше не используется в процессе или на месте; только эта категория может быть доступна для других приложений, таких как электромобили на топливных элементах.
Водород в качестве побочного продукта представляет собой интересный и дешевый источник водорода, необходимый для развертывания применения водорода в области его производства. Неудивительно, что регионы с большим количеством водорода в качестве побочного продукта являются одними из самых продвинутых в своей стратегии использования водорода.
.