Какой продукт образуется при окислении этанола перманганатом калия
Химические свойства спиртов | CHEMEGE.RU
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов
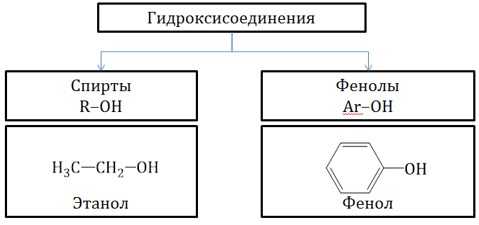
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH.
Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей .
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода. |
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
| Кислотные свойства одноатомных спиртов уменьшаются в ряду: CH3OH > первичные спирты > вторичные спирты > третичные спирты |
Многоатомные спирты также реагируют с активными металлами:
Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
| Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди: |
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
| Реакционная способность одноатомных спиртов в реакциях с галогеноводородами уменьшается в ряду: третичные > вторичные > первичные > CH3OH. |
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
| Например, этиленгликоль реагирует с бромоводородом: |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля: |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат: |
| Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин): |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
| Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода. |
| Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2: |
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир: |
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
| Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, при окислении пропанола-1 образуется пропаналь |
Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
| Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона |
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
| Например, уравнение сгорания метанола: |
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
| Например, при дегидрировании этанола образуется этаналь |
| Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль) |
Каков продукт окисления, когда этанол реагирует с перманганатом калия?
Наука
- Анатомия и физиология
- Астрономия
- Астрофизика
- Биология
- Химия
- наука о планете Земля
- Наука об окружающей среде
алкенов и манганат калия (VII) (перманганат)
Если продукт имеет одну углеводородную группу и один водород
Например, предположим, что первая стадия реакции была:
В этом случае первая молекула продукта имеет метильную группу и водород, присоединенный к карбонильная группа. Это другой вид соединения, известный как альдегид.
Альдегиды легко окисляются с образованием карбоновых кислот, содержащих группу -COOH.Итак, на этот раз реакция пойдет на следующую стадию, чтобы получить этановую кислоту, CH 3 COOH.
Структура кислоты была немного изменена, чтобы она больше походила на то, как мы обычно извлекаем кислоты, но в итоге кислород оказался между углеродом и водородом.
Таким образом, общий эффект манганата калия (VII) на этот вид алкена составляет:
Очевидно, если бы к обоим атомам углерода на концах двойной связи углерод-углерод был присоединен атом водорода, вы бы получили две молекулы карбоновой кислоты, которые могли бы быть одинаковыми или разными, в зависимости от того, были ли одинаковые алкильные группы. или другое.
Поиграйте с этим, пока не будете довольны. Нарисуйте несколько алкенов, каждый из которых имеет водород, присоединенный к обоим концам двойной углерод-углеродной связи. Меняйте алкильные группы - иногда одинаковые на каждом конце двойной связи, иногда разные. Окислите их, чтобы образовались кислоты, и посмотрите, что у вас получится.
Если продукт содержит два атома водорода, но не содержит углеводородной группы
Вы, возможно, ожидали, что это приведет к образованию метановой кислоты, как в уравнении:
Но это не так! Это потому, что метановая кислота также легко окисляется раствором манганата калия (VII).Фактически, он полностью окисляет его до двуокиси углерода и воды.
Таким образом, уравнение в таком случае могло бы быть, например:
Точная природа другого продукта (в этом примере пропанона) будет варьироваться в зависимости от того, что было присоединено к правому атому углерода в двойной связи углерод-углерод.
Если бы на обоих концах двойной связи было два атома водорода (другими словами, если бы у вас был этен), то все, что вы получили бы, - это диоксид углерода и вода.
Сводка
Подумайте об обоих концах двойной связи углерод-углерод по отдельности, а затем объедините результаты.
-
Если на одном конце связи есть две алкильные группы, эта часть молекулы даст кетон.
-
Если есть одна алкильная группа и один водород на одном конце связи, эта часть молекулы даст карбоновую кислоту.
-
Если на одном конце связи есть два атома водорода, эта часть молекулы даст диоксид углерода и воду.
В чем смысл всего этого?
Работа с результатами поможет вам определить структуру алкена. Например, алкен C 4 H 8 имеет три структурных изомера:
Определите, какие из них дали бы каждый из следующих результатов, если бы их обрабатывали горячим концентрированным раствором манганата (VII) калия. Вышеуказанные изомеры: , а не в порядке A, B и C.
Не читайте ответы в зеленой рамке, пока не попробуете это.
-
Изомер A дает кетон (пропанон) и диоксид углерода.
-
Изомер B дает карбоновую кислоту (пропановую кислоту) и диоксид углерода.
-
Изомер C дает карбоновую кислоту (этановую кислоту).
Перманганат калия - Простая английская Википедия, бесплатная энциклопедия
Перманганат калия - неорганическое химическое соединение. Его химическая формула - KMnO 4 . Он содержит ионы калия и перманганата. Марганец находится в степени окисления +7. Он также известен как перманганат калия и кристаллов Конди . Перманганат калия - сильный окислитель, что означает, что он имеет тенденцию забирать электроны у других химических веществ.Он растворяется в воде с образованием пурпурных растворов. Если он испаряется, он образует фиолетово-черные блестящие кристаллы. [2] Имеет сладкий вкус и не имеет запаха. [1]
В 1659 году немецкий химик Иоганн Рудольф Глаубер расплавил смесь минерального пиролюзита и карбоната калия, чтобы получить материал, который при растворении в воде превратился в зеленый раствор (манганат калия). Он медленно менял цвет на фиолетовый ( перманганат калия ), а затем, наконец, на красный.Этот отчет является первым описанием производства перманганата калия.
Чуть менее 200 лет спустя лондонец по имени Генри Боллманн Конди был химиком. Он интересовался дезинфицирующими средствами и делал такие вещи, как озонированная вода . Он обнаружил, что когда он расплавил пиролюзит с гидроксидом натрия и растворил его в воде, получился раствор, обладающий хорошими дезинфицирующими свойствами. Он запатентовал это решение и продал его как Condy's Fluid . Проблема заключалась в том, что решение было не очень стабильным.Это было исправлено с помощью гидроксида калия, а не гидроксида натрия. Это дало более стабильный материал. Его также можно было высушить до такого же хорошего порошка перманганата калия. Этот порошок назывался кристаллов Конди или порошок Конди . Перманганат калия было легко сделать, поэтому Конди пытался помешать другим людям производить его и продавать сам.
Ранние фотографы использовали его в порошковой вспышке.
Применение в химической промышленности [изменить | изменить источник]
Перманганат калия используется как окислитель. [3] Он также используется в дезинфицирующих средствах и дезодорантах. Его можно использовать для производства самых разных химикатов. При очистке сточных вод он используется для избавления от сероводорода, вонючего токсичного газа. В аналитической химии иногда используется точная концентрация KMnO 4 , чтобы увидеть, сколько определенного восстановителя присутствует при титровании. Похожим образом он используется как реагент для древесной массы. При смешивании перманганата калия и формальдегида образуется слабый слезоточивый газ.
В качестве окислителя в органическом синтезе [изменить | изменить источник]
Разбавленные растворы KMnO 4 превращают алкены в диолы (гликоли). Это поведение также используется в качестве качественного теста на наличие двойных или тройных связей в молекуле, поскольку реакция делает раствор перманганата бесцветным. Иногда его называют реактивом Байера.
Концентрированные растворы окисляют метильную группу ароматического кольца, например толуол в бензойную кислоту.
KMnO 4 окисляет гидрохлорид псевдоэфедрина с образованием меткатинона, препарата Списка I.Следовательно, DEA ограничило его использование и продажу, классифицировав его как прекурсор, контролируемый Списком I. Перманганат калия внесен в список прекурсоров Таблицы I в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом наркотических средств и психотропных веществ. [2]
Кислоты и перманганат калия [изменить | изменить источник]
Концентрированная серная кислота реагирует с перманганатом калия с образованием оксида марганца (VII), который может быть взрывоопасным. [4] [5] [6] .В этой реакции также образуется озон. Озон может воспламенить бумагу, пропитанную спиртом. Эта реакция очень опасна.
- 6 KMnO 4 + 9 H 2 SO 4 → 6 MnSO 4 + 3 K 2 SO 4 + 9 H 2 O + 5 O 3
Концентрированный HCl образует хлор.
- 2 KMnO 4 + 16 HCl → 2 MnCl 2 + 2 KCl + 8 H 2 O + 5 Cl 2
Mn-содержащие продукты окислительно-восстановительных реакций зависят от pH.Кислые растворы перманганата восстанавливаются до бледно-розового иона Mn 2+ , как и в хлориде марганца (II). В нейтральном растворе перманганат восстанавливается до коричневого оксида марганца (IV), где Mn находится в степени окисления +4. Оксид марганца (IV) - это вещество, которое окрашивает кожу при нанесении на нее перманганата калия. Перманганат калия самопроизвольно восстанавливается в щелочном растворе до манганата калия зеленого цвета, где марганец находится в степени окисления +6.
Биомедицинское использование [изменить | изменить источник]
- Разбавленные растворы используются для лечения язвы (язвы) (0.25%), дезинфицирующее средство для рук (около 1%) и средство для лечения мягкого дерматита помфоликс или грибковых инфекций рук или ног.
- Разбавленный раствор подкисленного перманганата калия используется в гистологии для отбеливания меланина, который затемняет детали тканей.
- Перманганат калия можно использовать для дифференциации амилоидного АК от других типов амилоида, патологически откладываемых в тканях организма. Инкубация фиксированной ткани с перманганатом калия предотвратит окрашивание амилоида AA конго красным, в то время как другие типы амилоида не затронуты. [7] [8]
Разное [изменение | изменить источник]
Растворенный перманганат калия- Растворы KMnO 4 использовались вместе с 80% перекисью водорода для приведения в движение ракеты. В этом случае он получил название Z-Stoff. Этот порох до сих пор используется в торпедах.
- Разбавленный (10 мг / л) перманганат калия можно использовать для удаления улиток с растений перед помещением их в пресноводный аквариум.
- Высококачественный перманганат калия можно найти в магазинах товаров для бассейнов и используется в сельской местности для удаления железа и сероводорода (запах тухлых яиц) из колодезной воды.
- KMnO 4 часто входит в наборы для выживания вместе с глицерином или таблеткой глюкозы для разведения огня. Таблетку глюкозы можно измельчить, смешать с перманганатом калия, и она загорится, если потереть. Его также можно смешать с антифризом из автомобиля, чтобы развести огонь. Это может быть опасно и должно выполняться осторожно, окунув немного бумаги в антифриз, а затем добавив небольшое количество перманганата калия. Он также может стерилизовать воду и раны, поэтому его можно использовать в комплекте для выживания.
- KMnO 4 применяется для лечения некоторых паразитарных болезней рыб, для очистки питьевой воды, а также в качестве антидота при отравлении фосфором. В Африке он использовался как дезинфицирующее средство для овощей, таких как салат.
Твердый перманганат калия является сильным окислителем, поэтому его следует хранить отдельно от восстановителей. Для некоторых реакций требуется немного воды. Например, перманганат калия и сахарная пудра воспламенится (но не взорвутся) через несколько секунд после добавления капли воды. Райт-младший, Калкинс Э., Хамфри Р.Л. Лабораторное исследование . 1977 мар; 36 (3): 274-81. PMID 839739 .
Перманганат калия (Kmno4) | Использование, физические и химические свойства перманганата калия
Что такое перманганат калия?
-
Перманганат калия - это универсальное химическое соединение фиолетового цвета.
-
Это калиевая соль марганцевой кислоты.
-
Также известный как перманганат калия, он имеет много других названий, таких как минерал хамелеон, кристаллы Конди и гипермаган.
-
Перманганат калия был впервые произведен немецким химиком Иоганном Рудольфом Глаубером в 1659 году, но вскоре о нем забыли.Он был заново открыт британским химиком Генри Конди, который производил дезинфицирующие средства, известные как «кристаллы Конди». Перманганат калия имел большой успех.
-
Обладает окислительными свойствами, поэтому нашло разнообразное применение в медицинской и химической промышленности.
-
Его химическая формула - KMnO4.
Физические свойства перманганата калия - KMnO4
-
Это химическое соединение ярко-фиолетового или бронзового цвета.
-
Имеет плотность 2.7 г / мл, а его молярная масса составляет 158,034 г / моль.
-
Соединение не имеет запаха, т.е. не имеет запаха, но имеет сладкий вкус.
-
Он имеет высокую температуру плавления 2400 C.
-
Он в основном встречается в виде порошка, кристаллов или таблеток.
Химические свойства перманганата калия
-
Перманганат калия растворим в ацетоне, воде, пиридине, метаноле и уксусной кислоте.Он также легко растворяется в неорганических растворителях.
-
Имеет насыщенный фиолетовый цвет в концентрированном растворе и розовый цвет в разбавленном растворе.
Концентрированные и разбавленные растворы перманганата калия
-
Не горючий, но поддерживает горение других веществ.
-
В нормальных условиях это очень стабильное соединение, но при нагревании разлагается с образованием MnO2 и высвобождением кислорода.
2KMnO4 ∆ → K2MnO4 + MnO2 + O2
-
Это сильный окислитель (соединение, которое может легко передавать свой кислород другим веществам), образующий темно-коричневый диоксид марганца (MnO2), который окрашивает все, что есть органический.Он легко может принимать электроны от других веществ.
-
Он бурно реагирует с серной кислотой, приводя к взрыву.
-
Он немедленно вступает в реакцию с глицерином и простыми спиртами с образованием пламени и дыма.
Структура перманганата калия - KMnO4
-
Перманганат калия представляет собой ионное соединение, состоящее из катиона калия (K +) и перманганат-аниона (MnO4-).
-
В перманганат-анионе (MnO4-) атом марганца связан с четырьмя атомами кислорода тремя двойными связями и одной одинарной связью.Его структуру можно записать следующим образом.
-
Степень окисления марганца в этой соли +7.
-
Кристаллическая структура твердого KMnO4 орторомбическая. Каждая структура MnO4- присутствует в тетраэдрической геометрии.
Реакции перманганата калия (KMnO4)
Большинство реакций с перманганатом калия представляют собой окислительно-восстановительные реакции (химическая реакция, при которой одно вещество окисляется, а другое восстанавливается).
KMnO4 может окислять многие неорганические соединения.Среда раствора играет важную роль в определении продуктов реакции.
2KMnO4 + 5Na2SO3 + 3h3SO4🡪 2MnSO4 + 5Na2SO₄ + K2SO4 + 3h3O
2KMnO4 + 3K2SO3 + h3O 🡪 3K2SO4 + 2MnO2 + 2KOH
+ 3K2SO4 + 2MnO2 + 2KOH + Na2SO4 + 2KMNO4 при нагревании кристаллов 2KMNO4 .
2KMnO4 ∆ → K2MnO4 + MnO2 + O2
При разбавлении кристаллов перманганата под прямыми солнечными лучами выделяется кислород.
4KMnO4 + 2h3O Солнечный свет → 4KOH + 4MnO2 + 3O2
С серной кислотой:
2KMnO4 + h3SO4 🡪 Mn2O7 + K2SO₄ + h3O
С перекисью водорода:
2KMnO2 + 3hO2 + 3h 2KMnO2 + 3h СН2 + 2KMnO4 + 2h3O 🡪 Ch3OH – Ch3OH + 2MnO2 + 2KOH (с охлаждением).
-
Может окислять альдегиды с образованием карбоновых кислот.
-
Окисляет спирты с образованием карбонилов.
-
Он также может окислять атомы углерода с тройными связями с образованием дионов.
-
Он окисляет сахар до кислот, разрушая углеродный скелет по двойным связям.
Применение перманганата калия (KMnO4)
Применение в медицине
-
Перманганат калия действует как дезинфицирующее средство - из-за его окислительных свойств он может действовать как дезинфицирующее средство для лечения кожных инфекций, таких как дерматит, язвы и язвы , экзема и грибковые инфекции. При нанесении на небольшие раны он атакует внешнюю клеточную мембрану микроорганизма, окисляя ее и разрушая ее структуру.При больших ранах врачи рекомендуют водные ванны с перманганатом калия с разбавленными растворами. Необходимо соблюдать осторожность, так как чрезмерное использование этого химического вещества может вызвать раздражение и ожоги.
-
Может использоваться для промывания ран. Влажные раны, такие как язвы и абсцессы, можно промыть раствором перманганата калия. Это лечение убивает микробы и предотвращает вторичное инфицирование. Это также помогает высушить волдыри.
-
Он очень эффективен при лечении грибковой инфекции, которая называется микоз.Окислительное действие раствора перманганата убивает грибок, тем самым снимая такие симптомы, как зуд и жжение.
-
Может также использоваться для лечения аллергии, вызванной реакцией коммерческих красок для волос. Красители содержат окислитель, который разрушает пигмент меланина в волосах и позволяет красителю проникнуть внутрь. Из-за неполного действия красителя и окислителя иногда возникает аллергическая реакция, вызывающая дискомфорт и зуд. Раствор перманганата применяется в таком случае в виде компресса, чтобы облегчить симптомы и полностью окислить краситель.
Очистка воды
-
Используется на водоочистных сооружениях для уничтожения загрязняющих веществ, а также для удаления неприятного запаха из воды. Он окисляет железо, сероводород и марганец до твердых частиц, которые затем удаляются фильтрацией. При лечении не образуются токсичные вещества, поэтому его очень безопасно использовать.
-
Может также использоваться для очистки воды в плавательных бассейнах.
Аналитическая и органическая химия. Перманганат калия из-за его сильного цвета и окислительной природы используется в химических лабораториях в качестве реагента для расчета количества окисляемого вещества в образце.Это значение называется перманганатным значением.
В бумажной промышленности число каппа (количество стандартного раствора перманганата, потребляемого древесной массой) используется для определения количества химического вещества, необходимого для отбеливания целлюлозы. В лабораториях органической химии оно часто используется в реакциях с органическими соединениями.
Другое применение
-
В смеси с 80% сероводорода он действует как топливо для ракет и торпед.
-
В сельской местности он используется для удаления железа и сероводорода из колодезной воды.
-
Может также помочь удалить ржавчину с водопроводных труб.
-
Может использоваться для удаления улиток с растений перед переносом в аквариум.
-
Это важный компонент в наборах для выживания наряду с таблетками глицерина / глюкозы, где он может пригодиться при разжигании огня. Если натереть таблетки глюкозы порошком перманганата, можно разжечь огонь. Его также можно использовать для очистки воды и очищения ран.
-
Может применяться как противоядие при отравлении фосфором.
-
Часто используется для лечения паразитарных инфекций у рыб.
Влияние на здоровье
KMnO4 является опасным химическим веществом, так как даже кратковременное воздействие может вызвать дискомфорт. Соблюдая правила личной гигиены и принимая надлежащие меры предосторожности при обращении с перманганатом калия, можно избежать опасности для здоровья. Вот некоторые из его последствий для здоровья:
-
Концентрированный KMnO4 вызывает раздражение кожи и глаз. Длительное воздействие может необратимо повредить глаза.
-
При вдыхании может вызвать раздражение носа и горла. Даже легкие могут быть поражены, вызывая кашель, одышку и отек легких (скопление жидкости в легких).
-
KMnO4 может также влиять на печень и почки.
-
Длительное воздействие может повлиять на фертильность.