Какие продукты образуются при взаимодействии натрия с 1 бромпропаном
1-бромпропан, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p 1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Викторина 11 карточек Лии Хаас
Знание Геном TM
Сертифицировано Brainscape
Просмотрите более 1 миллиона курсов, созданных лучшими студентами, профессорами, издателями и экспертами, которые охватывают весь мир «усваиваемых» знаний.
-
Вступительные экзамены
-
Экзамены уровня A
-
Экзамены AP
-
Экзамены GCSE
-
Вступительные экзамены в магистратуру
-
Экзамены IGCSE
-
Международный бакалаврат
-
5 национальных экзаменов
-
Вступительные экзамены в университет
-
Профессиональные сертификаты
-
Бар экзамен
-
Водитель Эд
-
Финансовые экзамены
-
Сертификаты управления
-
Медицинские и сестринские сертификаты
-
Военные экзамены
-
MPRE
-
Другие сертификаты
-
Сертификаты технологий
-
TOEFL
-
Иностранные языки
-
арабский
-
китайский язык
-
французский язык
-
Немецкий
-
иврит
-
Итальянский
-
Японский
-
Корейский
-
Лингвистика
-
Другие иностранные языки
-
португальский
-
русский
-
испанский язык
-
TOEFL
-
Наука
-
Анатомия
-
Астрономия
-
Биохимия
-
Биология
-
Клеточная биология
-
Химия
-
наука о планете Земля
-
Наука об окружающей среде
-
Генетика
-
Геология
-
Наука о жизни
-
Морская биология
-
Метеорология
-
Микробиология
-
Молекулярная биология
-
Естественные науки
-
Океанография
-
Органическая химия
-
Периодическая таблица
-
Физическая наука
-
Физика
-
Физиология
-
Растениеводство
-
Класс науки
-
Зоология
-
Английский
-
Американская литература
-
Британская литература
-
Классические романы
-
Писательское творчество
-
английский
-
Английская грамматика
-
Художественная литература
-
Высший английский
-
Литература
-
Средневековая литература
-
Акустика
-
Поэзия
-
Пословицы и идиомы
-
Шекспир
-
Орфография
-
Vocab Builder
-
Гуманитарные и социальные науки
-
Антропология
-
Гражданство
-
Гражданское
-
Классика
-
Связь
-
Консультации
-
Уголовное правосудие
-
География
-
История
-
Философия
-
Политическая наука
-
Психология
-
Религия и Библия
-
Социальные исследования
-
Социальная работа
-
Социология
-
Математика
-
Алгебра
-
Алгебра II
-
Арифметика
-
Исчисление
-
Геометрия
-
Линейная алгебра
-
Математика
-
Таблицы умножения
-
Precalculus
-
Вероятность
-
Статистические методы
-
Статистика
-
Тригонометрия
-
Медицина и уход
-
Анатомия
-
Системы тела
-
Стоматология
-
Медицинские курсы и предметные области
-
Медицинские осмотры
-
Медицинские специальности
-
Медицинская терминология
-
Разные темы здравоохранения
-
Курсы медсестер и предметные области
-
Медсестринские специальности
-
Другие области здравоохранения
-
Фармакология
-
Физиология
-
Радиология и диагностическая визуализация
-
Ветеринарная
-
Профессии
-
ASVAB
-
Автомобильная промышленность
-
Авиация
-
Парикмахерская
-
Катание на лодках
-
Косметология
-
Бриллианты
-
Электрические
-
Электрик
-
Пожаротушение
-
Садоводство
-
Домашняя экономика
-
Садоводство
-
HVAC
-
Дизайн интерьера
-
Ландшафтная архитектура
-
Массажная терапия
-
Металлургия
-
Военные
-
Борьба с вредителями
-
Сантехника
-
Полицейская
-
Сточные Воды
-
Сварка
-
Закон
-
Закон Австралии
-
Банкротство
-
Бар экзамен
-
Бизнес Закон
-
Экзамен в адвокатуру Калифорнии
-
Экзамен CIPP
-
Гражданский процесс
-
Конституционное право
-
Договорное право
-
Корпоративное право
-
Уголовное право
-
Доказательство
-
Семейное право
-
Экзамен в адвокатуру Флориды
-
Страховое право
-
Интеллектуальная собственность
-
Международный закон
-
Закон
-
Закон и этика
-
Правовые исследования
-
Судебные разбирательства
-
MBE
-
MPRE
-
Закон о аптеках
-
Право собственности
-
Закон о недвижимости
-
Экзамен в адвокатуре Техаса
-
Проступки
-
Трасты и имения
-
Здоровье и фитнес
-
Альтернативная медицина
-
Класс здоровья и фитнеса
-
Здоровье и человеческое развитие
-
Урок здоровья
-
Наука о здоровье
-
Развитие человека
-
Человеческий рост и развитие
-
Душевное здоровье
-
Здравоохранение
-
Спорт и кинезиология
-
Йога
-
Бизнес и финансы
-
Бухгалтерский учет
-
Бизнес
-
Экономика
-
Финансы
-
Управление
-
Маркетинг
-
Недвижимость
-
Технологии и машиностроение
-
Архитектура
-
Биотехнологии
-
Компьютерное программирование
-
Компьютерная наука
-
Инженерное дело
-
Графический дизайн
-
Информационная безопасность
-
Информационные технологии
-
Информационные системы управления
-
Еда и напитки
-
Бармен
-
приготовление еды
-
Кулинарное искусство
-
Гостеприимство
-
Питание
-
Вино
-
Изобразительное искусство
-
Искусство
-
История искусства
-
Танец
-
Музыка
-
Другое изобразительное искусство
-
Случайное знание
-
Астрология
-
Блэк Джек
-
Культурная грамотность
-
Знание реабилитации
-
Мифология
-
Национальные столицы
-
Люди, которых вы должны знать
-
Покер
-
Чаша для викторины
-
Спортивные викторины
-
Карты Таро
1-бромпропан - Информация о веществе - ECHA
В разделе «Классификация и маркировка опасностей» показаны опасности вещества на основе стандартизированной системы заявлений и пиктограмм, установленных в соответствии с Регламентом CLP (Классификационная маркировка и упаковка). Регламент CLP гарантирует, что опасности, связанные с химическими веществами, четко доведены до сведения рабочих и потребителей в Европейском Союзе. В Регламенте CLP используются Глобальная гармонизированная система ООН (GHS) и Заявления об особых опасностях Европейского Союза (EUH).
Этот раздел основан на трех источниках информации (гармонизированная классификация и маркировка (CLH), регистрации REACH и уведомления CLP). Источник информации указан во вступительном предложении краткой характеристики опасности. Когда информация доступна во всех источниках, первые два отображаются как приоритетные.
Обратите внимание:
Целью информации, представленной в этом разделе, является выделение опасности вещества в удобочитаемом формате.Он не представляет собой новую маркировку, классификацию или заявление об опасности, а также не отражает других факторов, которые влияют на восприимчивость описанных эффектов, таких как продолжительность воздействия или концентрация вещества (например, в случае потребительского и профессионального использования). Другая важная информация включает следующее:
- Вещества могут содержать примеси и добавки, которые приводят к различным классификациям. Если хотя бы одна компания указала, что на классификацию веществ влияют примеси или добавки, это будет указано в информативном предложении.Однако уведомления о веществах в InfoCard агрегируются независимо от примесей и добавок.
- Формулировки опасностей были адаптированы для облегчения чтения и могут не соответствовать тексту описания кодов формулировок опасности в Заявлениях об особых опасностях Европейского Союза (EUH) или Глобальной гармонизированной системе ООН (GHS).
Чтобы увидеть полный список заявленных классификаций и получить дополнительную информацию о примесях и добавках, относящихся к классификации, обратитесь к Реестру C&L.
Более подробная информация о классификации и маркировке доступна в разделе «Правила» на веб-сайте ECHA.
Дополнительная помощь доступна здесь.
Гармонизированная классификация и маркировка (CLH)
Гармонизированная классификация и маркировка - это юридически обязательная классификация и маркировка вещества, согласованная на уровне Европейского сообщества. Гармонизация основана на оценке физической, токсикологической и экотоксикологической опасности вещества.
В разделе «Классификация и маркировка опасностей» в качестве основного источника информации используются сигнальное слово, пиктограмма (пиктограммы) и сведения об опасности вещества в соответствии с Согласованной классификацией и маркировкой (CLH).
Если вещество охвачено более чем одной записью CLH (например, тетраборат динатрия EC № 215–540–4, охватывается тремя гармонизациями & двоеточие; 005–011–00–4; 005–011–01–1 и 005– 011–02–9), информация о CLH не может быть отображена в InfoCard, поскольку различие между классификациями CLH требует ручной интерпретации или проверки. Если вещество классифицируется по нескольким записям CLH, предоставляется ссылка на C&L Inventory, чтобы пользователи могли просматривать информацию CLH, связанную с веществом, и никакой текст для InfoCard автоматически не создается.
Возможно, что гармонизация будет введена путем внесения поправки в Регламент CLP. В этом случае отображается номер ATP (адаптация к техническому прогрессу).
Более подробную информацию о CLH можно найти здесь.
Классификация и маркировка согласно REACH
Дополнительная информация о классификации и маркировке (C&L), если таковая имеется, получена из регистрационных досье REACH, представленных отраслями промышленности. Эта информация не проверялась и не проверялась ECHA и может быть изменена без предварительного уведомления.Регистрационные досье REACH содержат более строгие требования к данным (например, подтверждающие исследования), чем к уведомлениям согласно CLP.
Уведомления в соответствии с Положением о классификационной маркировке и упаковке (CLP)
Если не существует гармонизированной классификации и маркировки ЕС и вещество не было зарегистрировано в соответствии с REACH, информация, полученная из уведомлений о классификации и маркировке (C&L) в ECHA в соответствии с Регламентом CLP, является отображается в этом разделе. Эти уведомления могут быть предоставлены производителями, импортерами и последующими пользователями.ECHA ведет реестр C&L, но не проверяет и не проверяет точность информации.
Обратите внимание, что для удобства чтения отображаются только пиктограммы, сигнальные слова и предупреждения об опасности, упомянутые в более чем 5% уведомлений в рамках CLP.
.натрия | Факты, использование и свойства
Натрий (Na) , химический элемент группы щелочного металла (Группа 1 [Ia]) периодической таблицы. Натрий - очень мягкий серебристо-белый металл. Натрий - самый распространенный щелочной металл и шестой по распространенности элемент на Земле, составляющий 2,8 процента земной коры. Он широко встречается в природе в виде соединений, особенно поваренной соли - хлорида натрия (NaCl), который образует минеральный галит и составляет около 80 процентов растворенных компонентов морской воды.
 Encyclopædia Britannica, Inc.
Encyclopædia Britannica, Inc. 
Британская викторина
118 Названия и символы из таблицы Менделеева
HS
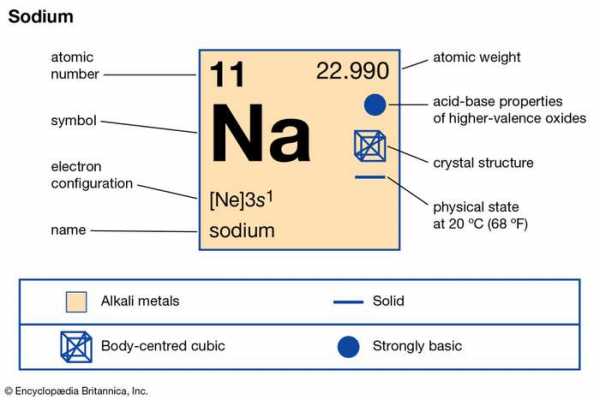
| атомный номер | 11 |
|---|---|
| атомный вес | 22.9898 |
| точка плавления | 97,81 ° C (208 ° F) |
| точка кипения | 882,9 ° C (1621 ° F) |
| удельный вес | 0,971 (20 ° C) |
| степени окисления | +1, −1 (редко) |
| электронная конфигурация | 2-8-1 или 1 с 2 2 с 2 2 p 6 3 s 1 |
Свойства и производство
Поскольку натрий чрезвычайно реактивен, он никогда не встречается в свободном состоянии в земной коре.В 1807 году сэр Хамфри Дэви стал первым, кто получил натрий в его элементарной форме, применив электролиз к плавленому гидроксиду натрия (NaOH). Натрий является важным компонентом ряда силикатных материалов, таких как полевые шпаты и слюды. В разных частях света есть огромные залежи каменной соли, а в Чили и Перу есть месторождения нитрата натрия. Содержание натрия в море составляет приблизительно 1,05 процента, что соответствует концентрации галогенидов натрия приблизительно 3 процента. Натрий был идентифицирован как в атомной, так и в ионной формах в спектрах звезд, включая Солнце, и в межзвездной среде.Анализ метеоритов показывает, что присутствующий силикатный материал в среднем содержит примерно 4,6 атома натрия на каждые 100 атомов кремния.
 Сэр Хамфри Дэви
Сэр Хамфри Дэви Сэр Хэмфри Дэви, фрагмент масляной картины после сэра Томаса Лоуренса; в Национальной портретной галерее в Лондоне.
Предоставлено Национальной портретной галереей, ЛондонНатрий легче воды, его можно разрезать ножом при комнатной температуре, но он хрупкий при низких температурах.Он легко проводит тепло и электричество и в значительной степени проявляет фотоэлектрический эффект (испускание электронов при воздействии света).
Натрий - безусловно, самый коммерчески важный щелочной металл. Большинство процессов производства натрия включают электролиз расплавленного хлорида натрия. Недорогой и доступный в количествах в цистернах, этот элемент используется для производства присадок к бензину, полимеров, таких как нейлон и синтетический каучук, фармацевтических препаратов и ряда металлов, таких как тантал, титан и кремний.Он также широко используется в качестве теплообменника и в натриевых лампах. Желтый цвет натриевой лампы и натриевого пламени (основа аналитического теста на натрий) идентифицируется двумя заметными линиями в желтой части светового спектра.
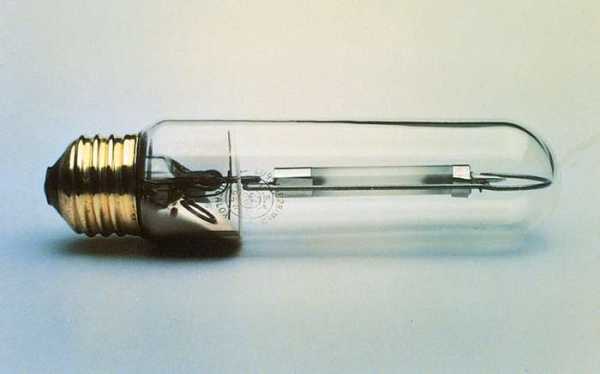
Колба натриевой лампы высокого давления.
(вверху и в центре) W.H. Роудс и Г. Вэй в R.W. Cahn и M.B. Bever (eds.), Encyclopedia of Materials Science and Engineering, Supplementary Vol. 3, © 1993 Pergamon Press; (внизу) General Electric Company Получите эксклюзивный доступ к контенту нашего 1768 First Edition с подпиской.Подпишитесь сегодняСущественные области применения
Два из самых первых применений металлического натрия были в производстве цианида натрия и пероксида натрия. Значительные количества использовались при производстве тетраэтилсвинца в качестве присадки к бензину, рынок, который исчез с появлением неэтилированного бензина. Значительные количества натрия используются при производстве алкилсульфатов натрия в качестве основного ингредиента синтетических моющих средств.
Натрий также используется в качестве исходного материала при производстве гидрида натрия (NaH) и боргидрида натрия (NaBH 4 ).Кроме того, натрий используется в производстве красителей и промежуточных продуктов красителей, в синтезе духов и в большом количестве органических восстановлений. Он используется при очистке углеводородов и при полимеризации непредельных углеводородов. Во многих органических применениях натрий используется в форме дисперсий в жидких углеводородных средах.
Расплавленный натрий является отличным теплоносителем, и благодаря этому свойству он нашел применение в качестве теплоносителя в жидкометаллических реакторах на быстрых нейтронах.Натрий широко используется в металлургии в качестве раскислителя и восстановителя для получения кальция, циркония, титана и других переходных металлов. Промышленное производство титана включает восстановление тетрахлорида титана (TiCl 4 ) натрием. Продукция - металлический Ti и NaCl.
Основные соединения
Натрий обладает высокой реакционной способностью, образуя широкий спектр соединений почти со всеми неорганическими и органическими анионами (отрицательно заряженными ионами). Обычно он имеет степень окисления +1, и его единственный валентный электрон теряется с большой легкостью, давая бесцветный катион натрия (Na + ).Также были синтезированы соединения, содержащие анион натрия Na - . Основными промышленными соединениями натрия являются хлорид, карбонат и сульфат.
Наиболее важным и знакомым соединением натрия является хлорид натрия или поваренная соль NaCl. Большинство других соединений натрия получают прямо или косвенно из хлорида натрия, который встречается в морской воде, в природных рассолах и в виде каменной соли. Большие количества хлорида натрия используются в производстве других тяжелых (промышленных) химикатов, а также используются непосредственно для удаления льда и снега, для кондиционирования воды и в продуктах питания.
 хлорид натрия
хлорид натрия Хлорид натрия.
HenningklevjerДругие основные коммерческие применения хлорида натрия включают его использование в производстве хлора и гидроксида натрия путем электролитического разложения и в производстве карбоната натрия (Na 2 CO 3 ) по способу Сольвея. Электролиз водного раствора хлорида натрия дает гипохлорит натрия, NaOCl, соединение натрия, кислорода и хлора, которое в больших количествах используется в бытовых отбеливателях с хлором.Гипохлорит натрия также используется в качестве промышленного отбеливателя для бумажной массы и текстиля, для хлорирования воды и в некоторых лекарственных препаратах в качестве антисептика и фунгицида. Это нестабильное соединение, известное только в водном растворе.
Карбонаты содержат карбонат-ион (CO 3 2–). Бикарбонат натрия, также называемый гидрокарбонатом натрия, или бикарбонатом соды, NaHCO 3 , является источником диоксида углерода и поэтому используется в качестве ингредиента в разрыхлителях, шипучих солях и напитках, а также в качестве основного компонента сухих продуктов. химические огнетушители.Его небольшая щелочность делает его полезным при лечении повышенной кислотности желудка или мочи и ацидоза. Он также используется в некоторых промышленных процессах, таких как дубление и выделка шерсти. Карбонат натрия, или кальцинированная сода, Na 2 CO 3 , широко распространен в природе, встречается в составе минеральных вод и в виде твердых минералов натрон, трона и термонатрит. В больших количествах эта щелочная соль используется для изготовления стекла, моющих и чистящих средств. Карбонат натрия обрабатывают диоксидом углерода для получения бикарбоната натрия.Моногидратная форма карбоната натрия, Na 2 CO 3 · H 2 O, широко используется в фотографии в качестве компонента проявителей.
 бикарбонат натрия
бикарбонат натрия Бикарбонат натрия (NaHCO3), также известный как пищевая сода или бикарбонат соды.
© Geo-grafika / Shutterstock.comСульфат натрия, Na 2 SO 4 , представляет собой белое кристаллическое твердое вещество или порошок, применяемый в производстве крафт-бумаги, картона, стекла и моющих средств, а также в качестве сырья. для производства различных химикатов.Его получают либо из месторождений сульфатных минералов мирабилита и тенардита, либо синтетическим путем путем обработки хлорида натрия серной кислотой. Кристаллизованный продукт представляет собой гидрат Na 2 SO 4 · 10H 2 O, широко известный как глауберова соль. Тиосульфат натрия (гипосульфит натрия), Na 2 S 2 O 3 , используется фотографами для фиксации проявленных негативов и отпечатков; он действует путем растворения части солей серебра, покрытых пленкой, которые остаются неизменными под воздействием света.
Гидроксид натрия (NaOH) представляет собой коррозионно-белое кристаллическое твердое вещество, которое легко впитывает влагу до растворения. Гидроксид натрия, обычно называемый каустической содой или щелоком, является наиболее широко используемой промышленной щелочью. Он вызывает сильную коррозию тканей животных и растений. Щелочные растворы, которые он образует при растворении в воде, нейтрализуют кислоты в различных промышленных процессах: при переработке нефти он удаляет серную и органические кислоты; в мыловарении реагирует с жирными кислотами. Растворы NaOH используются при обработке целлюлозы и производстве многих химикатов.
 испаритель
испаритель Испаритель с падающей пленкой для концентрирования растворов каустической соды (гидроксида натрия).
Рубен КастельнуовоНитрат натрия, или нитрат натрия, NaNO 3 , обычно называют чилийской селитрой, по названию основного источника минеральных отложений на севере Чили. Нитрат натрия используется как азотное удобрение и как компонент динамита.
.








