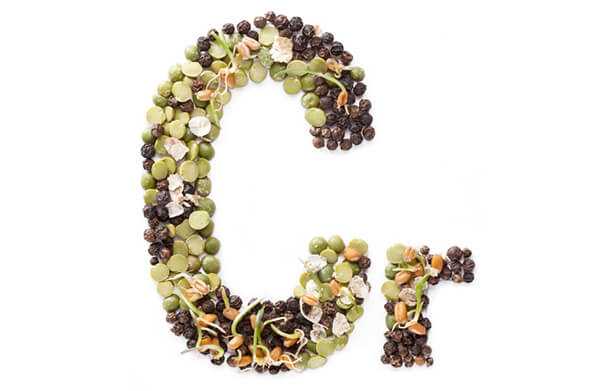Какие продукты образуются при внутримолекулярной дегидратации следующих соединений
Химические свойства спиртов | CHEMEGE.RU
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов
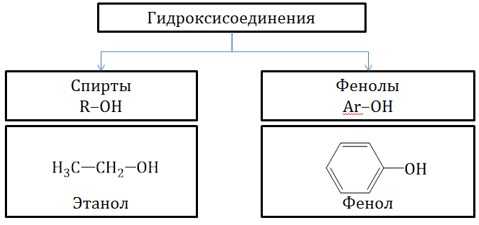
| Спирты – это гидроксисоединения, в которых группа ОН соединена с
алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода. |
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
| Кислотные свойства одноатомных спиртов уменьшаются в ряду: CH3OH > первичные спирты > вторичные спирты > третичные спирты |
Многоатомные спирты также реагируют с активными металлами:
Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
| Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди: |
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
| Реакционная способность одноатомных спиртов в реакциях с галогеноводородами уменьшается в ряду: третичные > вторичные > первичные > CH3OH. |
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
| Например, этиленгликоль реагирует с бромоводородом: |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля: |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат: |
| Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин): |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
| Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода. |
| Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2: |
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир: |
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
| Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, при окислении пропанола-1 образуется пропаналь |
Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
| Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона |
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
| Например, уравнение сгорания метанола: |
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
| Например, при дегидрировании этанола образуется этаналь |
| Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль) |
Причины, симптомы, лечение и многое другое
Обезвоживание
Обезвоживание происходит, когда ваше тело теряет больше жидкости, чем вы пьете. К распространенным причинам относятся:
- чрезмерное потоотделение
- рвота
- диарея
Клиника Майо рекомендует женщинам выпивать 92 жидких унции (11,5 стакана) в день, а мужчинам - 124 жидких унции (15,5 стакана) в день. Людям в пути, спортсменам и людям, подвергающимся воздействию высоких температур, следует увеличить потребление воды, чтобы избежать обезвоживания.
Когда организм теряет слишком много воды, его органы, клетки и ткани перестают функционировать должным образом, что может привести к опасным осложнениям. Если не устранить обезвоживание немедленно, это может вызвать шок.
Обезвоживание может быть легким или тяжелым. Обычно легкое обезвоживание можно лечить дома. Сильное обезвоживание необходимо лечить в больнице или в условиях неотложной помощи.
Не только атлеты, подвергающиеся воздействию прямых солнечных лучей, подвержены риску обезвоживания. Фактически, бодибилдеры и пловцы также входят в число спортсменов, у которых часто развивается это состояние.Как ни странно, в воде можно вспотеть. Пловцы во время плавания сильно потеют.
У некоторых людей риск развития обезвоживания выше, чем у других, в том числе:
- люди, работающие на открытом воздухе, которые подвергаются чрезмерному воздействию тепла (например, сварщики, ландшафтные дизайнеры, строительные рабочие и механики)
- пожилые люди
- люди с хроническими заболеваниями
- спортсменов (особенно бегунов, велосипедистов и футболистов)
- младенцев и детей раннего возраста
- человек, проживающих на большой высоте
Ваше тело регулярно теряет воду из-за потоотделения и мочеиспускания.Если не заменить воду, вы обезвоживаетесь. Любая ситуация или состояние, из-за которых организм теряет больше воды, чем обычно, приводит к обезвоживанию.
Потоотделение
Потоотделение - часть процесса естественного охлаждения вашего тела. Когда вам становится жарко, ваши потовые железы активируются, выделяя влагу из вашего тела, пытаясь охладить его. Это работает испарением.
Когда капля пота испаряется с кожи, она забирает с собой небольшое количество тепла. Чем больше пота вы производите, тем больше испаряется и тем больше вы остываетесь.Потоотделение также увлажняет кожу и поддерживает баланс электролитов в организме.
Жидкость, которую вы потеете, в основном состоит из соли и воды. Чрезмерное потоотделение может вызвать обезвоживание, так как вы теряете большое количество воды. Технический термин, обозначающий повышенное потоотделение, - гипергидроз.
Болезнь
Болезни, вызывающие постоянную рвоту или диарею, могут привести к обезвоживанию. Это связано с тем, что из-за рвоты и диареи из организма выводится слишком много воды.
Важные электролиты также теряются в результате этих процессов. Электролиты - это минералы, используемые организмом для управления мышцами, химическим составом крови и процессами в органах. Эти электролиты содержатся в крови, моче и других жидкостях организма.
Рвота или диарея могут нарушить эти функции и вызвать серьезные осложнения, такие как инсульт и кома.
Лихорадка
Если у вас жар, ваше тело теряет жидкость через поверхность кожи, пытаясь снизить температуру.Часто из-за жара вы так сильно вспотеете, что, если вы не будете пить, чтобы восполнить запасы энергии, у вас может закончиться обезвоживание.
Мочеиспускание
Мочеиспускание - это нормальный способ вывода токсинов из организма. Некоторые условия могут вызвать химический дисбаланс, что может увеличить диурез. Если вы не восполните жидкость, потерянную при чрезмерном мочеиспускании, вы рискуете развить обезвоживание.
Симптомы обезвоживания различаются в зависимости от того, является ли состояние легким или тяжелым.Симптомы обезвоживания могут появиться еще до полного обезвоживания.
Симптомы легкого или умеренного обезвоживания включают:
Помимо симптомов легкого обезвоживания, сильное обезвоживание может вызвать следующее:
Тяжелое обезвоживание требует неотложной медицинской помощи. Немедленно обратитесь за медицинской помощью, если у вас появятся какие-либо из этих признаков или симптомов.
Скорая медицинская помощь
Детям и пожилым людям следует немедленно оказать помощь, даже если они испытывают симптомы легкого обезвоживания.
Если у человека любой возрастной группы развиваются следующие симптомы, обратитесь за неотложной помощью:
Перед тем, как начать какие-либо анализы, ваш врач изучит любые симптомы, которые у вас есть, чтобы исключить другие заболевания. После сбора вашей истории болезни врач проверит ваши жизненно важные функции, включая частоту сердечных сокращений и артериальное давление. Низкое кровяное давление и учащенное сердцебиение могут указывать на обезвоживание.
Ваш врач может использовать анализ крови, чтобы проверить уровень электролитов, который может помочь определить потерю жидкости.Анализ крови также может проверить уровень креатинина в вашем организме. Это поможет вашему врачу определить, насколько хорошо работают ваши почки, что является показателем степени обезвоживания.
Общий анализ мочи - это исследование, при котором образец мочи используется для проверки наличия бактерий и потери электролитов. Цвет вашей мочи также может указывать на обезвоживание в сочетании с другими симптомами. Сама по себе темная моча не может диагностировать обезвоживание.
Лечения обезвоживания включают методы регидратации, замену электролитов и, при необходимости, лечение диареи или рвоты.
Регидратация
Регидратация путем питья может быть возможна не для всех людей, например для тех, у кого сильная диарея или рвота. В этом случае жидкости можно вводить внутривенно.
Для этого в вену руки или кисти вводится небольшая внутривенная трубка. Он обеспечивает раствор, который часто представляет собой смесь воды и электролитов.
Тем, кто способен пить, может быть рекомендована питьевая вода вместе с напитком для регидратации, содержащим электролиты, например, спортивный напиток с низким содержанием сахара или электролитный напиток.Детям с обезвоживанием часто рекомендуют пить Педиалит.
Домашний раствор для регидратации
Если электролитный напиток недоступен, вы можете приготовить свой собственный раствор для регидратации, используя:
- 1/2 чайной ложки соли
- 6 чайных ложек сахара
- 1 литр воды
Будьте абсолютно уверены, что вы используете точное измерение. Использование слишком большого количества соли или сахара может быть опасным.
Чего следует избегать
Избегайте газированных напитков, алкоголя, чрезмерно сладких напитков или кофеина.Эти напитки могут усугубить обезвоживание.
Нелеченное обезвоживание может привести к опасным для жизни осложнениям, например:
Вот несколько способов предотвратить обезвоживание:
- Если вы заболели, увеличьте потребление жидкости, особенно если у вас рвота или диарея. Если вы не можете пить, обратитесь за медицинской помощью.
- Если вы собираетесь заниматься спортом или заниматься спортом, выпейте воды перед занятием. Регулярно во время тренировки заменяйте жидкости.Не забывайте пить воду или электролиты после тренировки.
- Одевайтесь прохладно в жаркие месяцы и избегайте прямых источников тепла, если это возможно.
- Даже если вы не ведете активный образ жизни, пейте рекомендованное количество жидкости.
Обезвоживание происходит, когда вы не получаете достаточно жидкости. Будь то физические упражнения, жаркая погода или болезнь, обезвоживание может быстро стать опасным, независимо от причины.
Вы можете предотвратить обезвоживание, выпивая много воды в течение дня и принимая электролиты, если у вас появляются первые признаки потери жидкости.
.Влияниелетучих органических соединений на качество воздуха в помещении | Качество воздуха в помещении (IAQ)
На этой странице:
Введение
Летучие органические соединения (ЛОС) выделяются в виде газов из определенных твердых или жидких веществ. ЛОС включают множество химических веществ, некоторые из которых могут иметь краткосрочные и долгосрочные неблагоприятные последствия для здоровья. Концентрации многих ЛОС в помещении постоянно (до десяти раз выше), чем на открытом воздухе. ЛОС выбрасываются тысячами продуктов из широкого спектра продуктов.
Органические химические вещества широко используются в качестве ингредиентов в товарах для дома. Краски, лаки и воск содержат органические растворители, как и многие чистящие, дезинфицирующие, косметические, обезжиривающие средства и средства для хобби. Топливо состоит из органических химикатов. Все эти продукты могут выделять органические соединения, пока вы их используете, и, в некоторой степени, при хранении.
Управление исследований и разработок Агентства по охране окружающей среды (EPA) «Исследование методологии оценки общего воздействия (TEAM)» (тома с I по IV, завершенные в 1985 году) обнаружило, что уровни около дюжины обычных органических загрязнителей в домах в 2-5 раз выше, чем снаружи, независимо от были ли дома расположены в сельской или промышленной зоне.Исследования TEAM показали, что, хотя люди используют продукты, содержащие органические химические вещества, они могут подвергать себя и других воздействию очень высоких уровней загрязнителей, а повышенные концентрации могут сохраняться в воздухе еще долгое время после завершения деятельности.
Начало страницы
Источники ЛОС
Хозяйственные товары, в том числе:
- краски, средства для удаления краски и прочие растворители
- консерванты для древесины
- аэрозольные баллончики
- моющие и дезинфицирующие средства
- Репелленты и освежители воздуха
- хранимое топливо и автомобильная продукция
- принадлежности для хобби
- химчистка одежды
- пестицид
Продукция прочая, в том числе:
- строительные материалы и мебель
- Офисное оборудование, такое как копировальные аппараты и принтеры, корректирующие жидкости и безуглеродная копировальная бумага
- графические и ремесленные материалы, включая клеи и адгезивы, перманентные маркеры и фотографические решения.
Начало страницы
Воздействие на здоровье
Последствия для здоровья могут включать:
- Раздражение глаз, носа и горла
- Головные боли, потеря координации и тошнота
- Повреждение печени, почек и центральной нервной системы
- Некоторые органические вещества могут вызывать рак у животных, некоторые подозреваются или известны как вызывающие рак у людей.
Ключевые признаки или симптомы, связанные с воздействием ЛОС, включают:
- Раздражение конъюнктивы
- Дискомфорт в носу и горле
- головная боль
- кожная аллергическая реакция
- одышка
- снижение уровня холинэстеразы в сыворотке
- тошнота
- рвота
- носовое кровотечение
- усталость
- головокружение
Способность органических химикатов оказывать воздействие на здоровье сильно варьируется от тех, которые являются высокотоксичными, до тех, которые не имеют известного воздействия на здоровье.
Как и в случае с другими загрязнителями, степень и характер воздействия на здоровье будет зависеть от многих факторов, включая уровень воздействия и продолжительность воздействия. Среди непосредственных симптомов, которые некоторые люди испытали вскоре после контакта с некоторыми органическими веществами, входят:
- Раздражение глаз и дыхательных путей
- головные боли
- головокружение
- нарушение зрения и памяти
В настоящее время мало что известно о том, какое воздействие на здоровье оказывает уровень органических веществ, обычно обнаруживаемых в домах.
Начало страницы
Уровни в домах
Исследования показали, что уровни некоторых органических веществ в помещении в среднем в 2–5 раз выше, чем на открытом воздухе. Во время и в течение нескольких часов сразу после определенных действий, таких как снятие краски, уровни могут в 1000 раз превышать фоновые уровни на открытом воздухе.
Начало страницы
Шаги по уменьшению воздействия
- Увеличьте вентиляцию при использовании продуктов, выделяющих ЛОС.
- Соответствовать или превзойти все меры предосторожности, указанные на этикетке.
- Не храните в школе открытые емкости с неиспользованными красками и подобными материалами.
- Формальдегид, один из наиболее известных летучих органических соединений, является одним из немногих загрязнителей воздуха внутри помещений, которые можно легко измерить.
- Определите и, если возможно, удалите источник.
- Если удалить невозможно, уменьшите воздействие, нанеся герметик на все открытые поверхности обшивки и другой мебели.
- Используйте комплексные методы борьбы с вредителями, чтобы снизить потребность в пестицидах.
- Используйте товары для дома в соответствии с указаниями производителя.
- При использовании этих продуктов убедитесь, что вы обеспечиваете достаточное количество свежего воздуха.
- Осторожно выбрасывайте неиспользованные или малоиспользуемые контейнеры; покупайте в количестве, которое вы скоро будете использовать.
- Хранить в недоступном для детей и домашних животных.
- Никогда не смешивайте бытовые продукты, если они не указаны на этикетке.
Тщательно следуйте инструкциям на этикетке.
На потенциально опасных продуктах часто есть предупреждения, направленные на снижение воздействия на пользователя.Например, если на этикетке указано использовать продукт в хорошо вентилируемом помещении, выйдите на улицу или в места, оборудованные вытяжным вентилятором, чтобы использовать его. В противном случае откройте окна, чтобы обеспечить максимальное количество наружного воздуха.
Осторожно выбрасывайте частично заполненные контейнеры со старыми или ненужными химикатами.
Поскольку газы могут вытекать даже из закрытых контейнеров, этот единственный шаг может помочь снизить концентрацию органических химикатов в вашем доме. (Убедитесь, что материалы, которые вы решили оставить, хранятся не только в хорошо проветриваемом помещении, но и в недоступном для детей месте.) Не выбрасывайте эти ненужные продукты просто в мусорное ведро. Узнайте, спонсируют ли ваше местное правительство или какая-либо организация в вашем районе специальные дни для сбора токсичных бытовых отходов. Если такие дни доступны, используйте их, чтобы безопасно избавиться от ненужных контейнеров. Если таких дней сбора нет, подумайте об их организации.
Купить ограниченное количество.
Если вы используете продукты только изредка или сезонно, такие как краски, средства для удаления краски и керосин для обогревателей или бензин для газонокосилок, покупайте ровно столько, сколько вы будете использовать сразу.
Сведите к минимуму воздействие продуктов, содержащих хлористый метилен.
К потребительским товарам, содержащим хлористый метилен, относятся средства для удаления краски, средства для удаления клея и аэрозольные аэрозольные краски. Известно, что метиленхлорид вызывает рак у животных. Кроме того, метиленхлорид превращается в организме в моноксид углерода и может вызывать симптомы, связанные с воздействием монооксида углерода. Внимательно прочтите этикетки, содержащие информацию об опасности для здоровья и предупреждения о правильном использовании этих продуктов.По возможности используйте вне помещений продукты, содержащие хлористый метилен; использовать в помещении, только если помещение хорошо вентилируется.
Сведите к минимуму воздействие бензола.
Бензол - известный канцероген для человека. Основные внутренние источники этого химического вещества:
- Экологический табачный дым
- хранимое топливо
- расходные материалы
- автомобильные выбросы в пристроенных гаражах
Действия, которые уменьшат воздействие бензола, включают:
- Отказ от курения в доме
- обеспечивает максимальную вентиляцию во время покраски
- Отказ от лакокрасочных материалов и специального топлива, которые не будут использоваться немедленно
Сведите к минимуму воздействие выбросов перхлорэтилена из недавно прошедших химчистку материалов.
Перхлорэтилен - химическое вещество, наиболее широко используемое в химической чистке. В лабораторных исследованиях было показано, что он вызывает рак у животных. Недавние исследования показывают, что люди вдыхают низкий уровень этого химического вещества как в домах, где хранятся химчистки, так и когда они носят одежду, подвергшуюся химической чистке. Химчистки улавливают перхлорэтилен во время процесса химической чистки, поэтому они могут сэкономить деньги за счет его повторного использования, а также удаляют больше химикатов во время процессов прессования и отделки.Однако некоторые химчистки не всегда удаляют столько перхлорэтилена, сколько возможно.
Разумно принимать меры для сведения к минимуму воздействия этого химического вещества.
- Если товары, прошедшие химчистку, имеют сильный химический запах, когда вы их забираете, не принимайте их, пока они не будут должным образом высушены.
- Если при последующих посещениях вам будут возвращены товары с химическим запахом, попробуйте другую химчистку.
Начало страницы
Стандарты или инструкции
Для ЛОС в непромышленных условиях не установлены обязательные федеральные стандарты.Чтобы узнать больше о летучих органических соединениях, включая текущие руководящие принципы или рекомендации, установленные различными организациями в отношении концентраций формальдегида, посетите Банк ресурсов научных данных по качеству воздуха в помещениях Национальной лаборатории Лоуренса Беркли.
Начало страницы
Дополнительные ресурсы
Начало страницы
.химическое соединение | Определение, примеры и типы
Химическое соединение , любое вещество, состоящее из идентичных молекул, состоящих из атомов двух или более химических элементов.
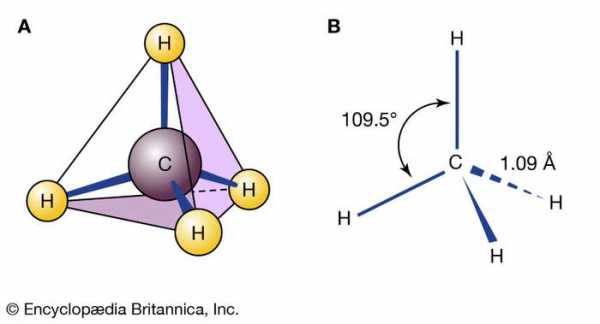 молекула метана
молекула метана Метан, в котором четыре атома водорода связаны с одним атомом углерода, является примером основного химического соединения. На структуру химических соединений влияют сложные факторы, такие как валентные углы и длина связи.
Encyclopædia Britannica, Inc.
Британская викторина
Подводки к химии
Какой из этих элементов не является редкоземельным элементом?
Вся материя Вселенной состоит из атомов более чем 100 различных химических элементов, которые встречаются как в чистом виде, так и в сочетании в химических соединениях.Образец любого данного чистого элемента состоит только из атомов, характерных для этого элемента, и атомы каждого элемента уникальны. Например, атомы углерода отличаются от атомов железа, которые, в свою очередь, отличаются от атомов золота. Каждый элемент обозначается уникальным символом, состоящим из одной, двух или трех букв, возникающих либо из текущего имени элемента, либо из его исходного (часто латинского) имени. Например, символы углерода, водорода и кислорода - это просто C, H и O соответственно.Символ железа - Fe, от оригинального латинского названия ferrum . Фундаментальный принцип химической науки состоит в том, что атомы различных элементов могут объединяться друг с другом с образованием химических соединений. Например, метан, который образован из элементов углерода и водорода в соотношении четыре атома водорода на каждый атом углерода, как известно, содержит различные молекулы CH 4 . Формула соединения - например, CH 4 - указывает типы присутствующих атомов, с нижними индексами, представляющими относительное количество атомов (хотя цифра 1 никогда не записывается).
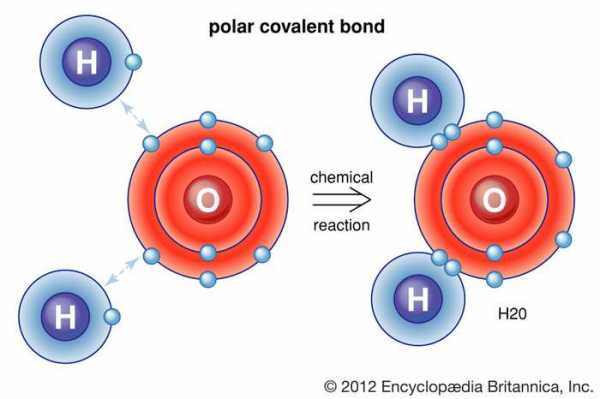 молекула воды
молекула воды Молекула воды состоит из двух атомов водорода и одного атома кислорода. Один атом кислорода содержит шесть электронов на своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc.-
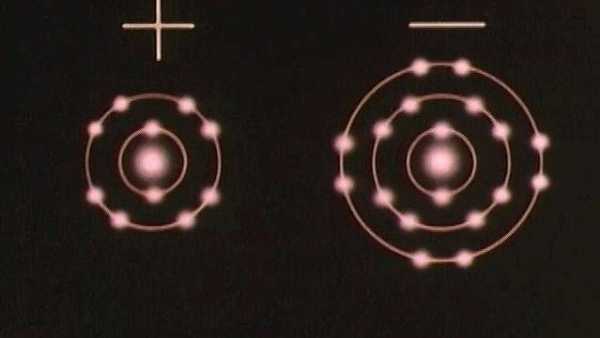 Исследуйте магнитоподобную ионную связь, образующуюся при передаче электронов от одного атома к другому
Исследуйте магнитоподобную ионную связь, образующуюся при передаче электронов от одного атома к другому Ионы - атомы с положительным или отрицательным суммарным зарядом - связываются вместе, образуя ионные соединения.
Encyclopædia Britannica, Inc. См. Все видео для этой статьи -
 Посмотрите, как работают молекулярные связи, когда два атома водорода присоединяются к атому серы, образуя сероводород
Посмотрите, как работают молекулярные связи, когда два атома водорода присоединяются к атому серы, образуя сероводород Молекулярные соединения образуются, когда молекулы, такие как молекулы метана или вода, соединяются вместе, разделяя электроны.
Encyclopædia Britannica, Inc. Посмотреть все видео по этой статье
Вода, которая представляет собой химическое соединение водорода и кислорода в соотношении два атома водорода на каждый атом кислорода, содержит молекулы H 2 O.Хлорид натрия - это химическое соединение, образованное из натрия (Na) и хлора (Cl) в соотношении 1: 1. Хотя формула хлорида натрия - NaCl, соединение не содержит реальных молекул NaCl. Скорее, он содержит равное количество ионов натрия с положительным зарядом (Na + ) и ионов хлора с отрицательным зарядом (Cl - ). ( См. Ниже Тенденции в химических свойствах элементов, где обсуждается процесс превращения незаряженных атомов в ионы [i.е., виды с положительным или отрицательным суммарным зарядом].) Упомянутые выше вещества представляют собой два основных типа химических соединений: молекулярные (ковалентные) и ионные. Метан и вода состоят из молекул; то есть они являются молекулярными соединениями. С другой стороны, хлорид натрия содержит ионы; это ионное соединение.
Атомы различных химических элементов можно сравнить с буквами алфавита: так же, как буквы алфавита объединяются, образуя тысячи слов, атомы элементов могут объединяться различными способами, образуя бесчисленное множество соединений. .На самом деле известны миллионы химических соединений, и многие миллионы возможны, но еще не открыты или синтезированы. Большинство веществ, встречающихся в природе, таких как древесина, почва и камни, представляют собой смеси химических соединений. Эти вещества могут быть разделены на составляющие их соединения физическими методами, которые не изменяют способ агрегирования атомов в соединениях. Соединения можно разделить на составные элементы путем химических изменений.Химическое изменение (то есть химическая реакция) - это изменение, при котором изменяется организация атомов. Пример химической реакции - горение метана в присутствии молекулярного кислорода (O 2 ) с образованием диоксида углерода (CO 2 ) и воды. CH 4 + 2O 2 → CO 2 + 2H 2 O В этой реакции, которая является примером реакции горения, происходят изменения в том, как атомы углерода, водорода и кислорода связаны друг с другом. в соединениях.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодняХимические соединения обладают поразительным набором характеристик. При обычных температурах и давлениях некоторые из них являются твердыми телами, некоторые - жидкостями, а некоторые - газами. Цвета различных составных частей совпадают с цветами радуги. Некоторые соединения очень токсичны для человека, тогда как другие необходимы для жизни. Замена только одного атома в соединении может быть причиной изменения цвета, запаха или токсичности вещества.Чтобы понять это огромное разнообразие, были разработаны системы классификации. В приведенном выше примере соединения классифицируются как молекулярные или ионные. Соединения также подразделяются на органические и неорганические. Органические соединения ( см. Ниже Органические соединения), названные так потому, что многие из них были первоначально изолированы от живых организмов, обычно содержат цепи или кольца из атомов углерода. Из-за огромного разнообразия способов связывания углерода и других элементов существует более девяти миллионов органических соединений.Соединения, которые не считаются органическими, называются неорганическими соединениями ( см. Ниже Неорганические соединения).
 ртуть (Hg)
ртуть (Hg) Ртуть (химический символ: Hg) - единственный металлический элемент, который является жидким при комнатной температуре.
© marcel / FotoliaВ рамках широкой классификации органических и неорганических веществ существует множество подклассов, в основном основанных на конкретных элементах или группах присутствующих элементов. Например, среди неорганических соединений оксиды содержат ионы O 2- или атомы кислорода, гидриды содержат ионы H - или атомы водорода, сульфиды содержат ионы S 2- и т. Д.Подклассы органических соединений включают спирты (содержащие группу OH), карбоновые кислоты (характеризующиеся группой COOH), амины (содержащие группу NH 2 ) и так далее.
Различные способности различных атомов объединяться с образованием соединений лучше всего можно понять с помощью периодической таблицы. Периодическая таблица Менделеева была первоначально построена для представления закономерностей, наблюдаемых в химических свойствах элементов ( см. химическая связь). Другими словами, по мере развития химии было замечено, что элементы можно сгруппировать в соответствии с их химической реакционной способностью.Элементы с подобными свойствами перечислены в вертикальных столбцах периодической таблицы и называются группами. По мере раскрытия деталей атомной структуры стало ясно, что положение элемента в периодической таблице коррелирует с расположением электронов, которыми обладают атомы этого элемента ( см. Атом ). В частности, было замечено, что электроны, которые определяют химическое поведение атома, находятся в его внешней оболочке. Такие электроны называются валентными электронами.
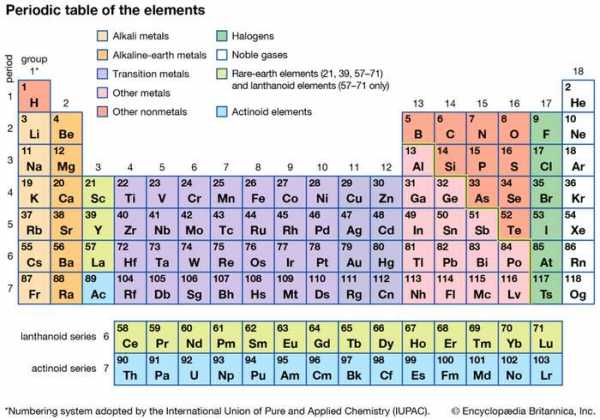 таблица Менделеева
таблица Менделеева Периодическая таблица элементов.
Encyclopædia Britannica, Inc.Например, атомы элементов в группе 1 периодической таблицы все имеют один валентный электрон, атомы элементов в группе 2 имеют два валентных электрона, и так далее, до группы 18 , элементы которого содержат восемь валентных электронов. Самое простое и самое важное правило для предсказания того, как атомы образуют соединения, заключается в том, что атомы имеют тенденцию объединяться таким образом, чтобы они могли либо опустошить свою валентную оболочку, либо завершить ее (т.е., заполните его), в большинстве случаев всего с восемью электронами. Элементы в левой части таблицы Менделеева имеют тенденцию терять свои валентные электроны в химических реакциях. Натрий (в Группе 1), например, имеет тенденцию терять свой одинокий валентный электрон с образованием иона с зарядом +1. Каждый атом натрия имеет 11 электронов ( e - ), каждый с зарядом -1, чтобы просто сбалансировать заряд +11 на его ядре. Потеря одного электрона оставляет его с 10 отрицательными зарядами и 11 положительными зарядами, что дает суммарный заряд +1: Na → Na + + e -.Калий, расположенный непосредственно под натрием в группе 1, также образует ионы +1 (K + ) в своих реакциях, как и остальные члены группы 1: рубидий (Rb), цезий (Cs) и франций (Fr). Атомы элементов в правом конце периодической таблицы имеют тенденцию вступать в реакции, так что они получают (или разделяют) достаточно электронов, чтобы заполнить свою валентную оболочку. Например, кислород в группе 16 имеет шесть валентных электронов и, следовательно, нуждается в двух дополнительных электронах, чтобы завершить свою внешнюю оболочку. Кислород достигает этого за счет реакции с элементами, которые могут терять или делиться электронами.Атом кислорода, например, может реагировать с атомом магния (Mg) (в Группе 2), принимая два валентных электрона магния, образуя ионы Mg 2+ и O 2−. (Когда нейтральный атом магния теряет два электрона, он образует ион Mg 2+ , а когда нейтральный атом кислорода получает два электрона, он образует ион O 2-.) Получающийся в результате Mg 2+ и O 2- затем объединяют в соотношении 1: 1 с получением ионного соединения MgO (оксид магния). (Хотя составной оксид магния содержит заряженные частицы, у него нет чистого заряда, поскольку он содержит равное количество ионов Mg 2+ и O 2-.) Аналогичным образом кислород реагирует с кальцием (чуть ниже магния в группе 2) с образованием CaO (оксид кальция). Кислород аналогичным образом реагирует с бериллием (Be), стронцием (Sr), барием (Ba) и радием (Ra), остальными элементами группы 2. Ключевым моментом является то, что, поскольку все элементы в данной группе имеют одинаковое количество валентных электронов, они образуют аналогичные соединения.
Химические элементы можно классифицировать по-разному. Наиболее фундаментальное разделение элементов - на металлы, которые составляют большинство элементов, и неметаллы.Типичные физические свойства металлов - это блестящий внешний вид, пластичность (способность растираться в тонкий лист), пластичность (способность вытягиваться в проволоку), а также эффективная тепло- и электропроводность. Самым важным химическим свойством металлов является склонность отдавать электроны с образованием положительных ионов. Например, медь (Cu) - типичный металл. Он блестящий, но легко тускнеет; это отличный проводник электричества и обычно используется для электрических проводов; и из него легко превращаться в изделия различной формы, такие как трубы для систем водоснабжения.Медь содержится во многих ионных соединениях в форме иона Cu + или Cu 2+ .
Металлические элементы находятся на левой стороне и в центре таблицы Менделеева. Металлы групп 1 и 2 называются типичными металлами; те, что находятся в центре периодической таблицы, называются переходными металлами. Лантаноиды и актиноиды, показанные под периодической таблицей, представляют собой особые классы переходных металлов.
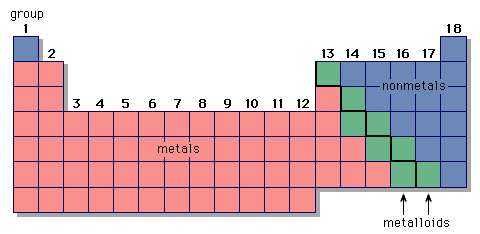 металлических элементов в периодической таблице Менделеева
металлических элементов в периодической таблице Менделеева Металлы, неметаллы и металлоиды представлены в различных частях периодической таблицы Менделеева.
Encyclopædia Britannica, Inc.Неметаллы, которых относительно мало, находятся в верхнем правом углу таблицы Менделеева, за исключением водорода, единственного неметаллического члена Группы 1. Физические свойства, характерные для металлы в неметаллах отсутствуют. В химических реакциях с металлами неметаллы приобретают электроны с образованием отрицательных ионов. Неметаллические элементы также реагируют с другими неметаллами, в этом случае образуя молекулярные соединения. Хлор - это типичный неметалл.При обычных температурах элементарный хлор содержит молекулы Cl 2 и реагирует с другими неметаллами с образованием таких молекул, как HCl, CCl 4 и PCl 3 . Хлор реагирует с металлами с образованием ионных соединений, содержащих ионы Cl - .
Разделение элементов на металлы и неметаллы является приблизительным. Некоторые элементы вдоль разделительной линии проявляют как металлические, так и неметаллические свойства и называются металлоидами или полуметаллами.
.19 Классные химические реакции, доказывающие, что наука увлекательна
Химия может быть одной из самых завораживающих, но также и опасных наук. Смешивание определенных химикатов может вызвать довольно неожиданные реакции, которые могут быть интересны для демонстрации. Хотя некоторые реакции можно наблюдать ежедневно, например, смешивание сахара с кофе, некоторые требуют контролируемых условий для визуализации эффектов. Но есть некоторые химические реакции, наблюдать за которыми просто потрясающе, и их легко провести в химических лабораториях.
Тем не менее, для вашей безопасности самый простой выход - посмотреть видео с такими впечатляющими химическими реакциями, прежде чем вы подумаете о воспроизведении их, чтобы лучше понять уровень риска и необходимые меры безопасности.
Вот список из 19 самых потрясающих химических реакций, которые доказывают, что наука всегда крута.
1. Полиакрилат натрия и вода
Полиакрилат натрия - это суперабсорбентный полимер. Подводя итог реакции, ионы полимера притягивают воду путем диффузии.Полимер поглощает воду за секунды, что приводит к почти мгновенному превращению в гелеобразное вещество. Именно это химическое вещество используется в подгузниках для поглощения отработанной жидкости. Технически это не химическая реакция, потому что химическая структура не меняется и не происходит реакции с молекулами воды. Скорее, это демонстрация поглощения в макроуровне.
2. Диэтилцинк и воздух
Диэтилцинк - очень нестабильное соединение.При контакте с воздухом он горит с образованием оксида цинка, CO2 и воды. Реакция происходит, когда диэтилцинк вступает в контакт с молекулами кислорода. Химическое уравнение выглядит следующим образом:
Zn (C2H5) 2 + 5O2 → ZnO + 4CO2 + 5h3O
3. Цезий и вода
Источник: GiphyЦезий - один из наиболее реактивных щелочных металлов. При контакте с водой он реагирует с образованием гидроксида цезия и газообразного водорода. Эта реакция происходит так быстро, что вокруг цезия образуется водородный пузырь, который поднимается на поверхность, который затем подвергает цезий воздействию воды, вызывая дальнейшую экзотермическую реакцию, таким образом воспламеняя газообразный водород.Этот цикл повторяется до тех пор, пока не будет исчерпан весь цезий.
4. Глюконат кальция
Глюконат кальция обычно используется для лечения дефицита кальция. Однако когда он нагревается, он вызывает огромное расширение молекулярной структуры. Это приводит к образованию пены, напоминающей серую змею, вызванной испарением воды и обезвоживанием гидроксильных групп внутри соединения. Говоря менее научным языком, при нагревании глюконат кальция быстро разлагается. Реакция следующая:
2C 12 H 22 CaO 14 + O 2 → 22H 2 O + 21C + 2CaO + 3CO 2
5.Трииодид азота
Вы можете приготовить это соединение дома, но имейте в виду, что это очень опасно. Соединение образуется в результате осторожной реакции йода и аммиака. После высыхания исходных компонентов образуется NI3, который является очень реактивным соединением. Простое прикосновение пера вызовет взрыв этого очень опасного контактного взрывчатого вещества.
6. Дихромат аммония
Когда дихромат аммония воспламеняется, он разлагается экзотермически с образованием искр, золы, пара и азота.
7. Перекись водорода и иодид калия
Когда перекись водорода и иодид калия смешиваются в надлежащих пропорциях, перекись водорода разлагается очень быстро. В эту реакцию часто добавляют мыло, чтобы в результате образовалось пенистое вещество. Мыльная вода улавливает кислород, продукт реакции, и создает множество пузырьков.
8. Хлорат калия и конфеты
Мармеладные мишки - это, по сути, просто сахароза.Когда мармеладные мишки попадают в хлорат калия, он вступает в реакцию с молекулой глюкозы в сахарозе, что приводит к сильно экзотермической реакции горения.
9. Реакция Белоусова-Жаботинского (BZ)
Реакция BZ образуется при осторожном сочетании брома и кислоты. Реакция является ярким примером неравновесной термодинамики, которая приводит к красочным химическим колебаниям, которые вы видите на видео выше.
10.Окись азота и сероуглерод
Реакция, часто называемая «лающей собакой», представляет собой химическую реакцию в результате воспламенения сероуглерода и закиси азота. Реакция дает яркую синюю вспышку и очевидный звук глухой. Реагенты реакции быстро разлагаются в процессе горения.
11. Сплав NaK и вода
Сплав NaK - это металлический сплав, образованный смешением натрия и калия вне воздуха - обычно в керосине.Этот чрезвычайно реактивный материал может реагировать с воздухом, но еще более бурная реакция происходит при контакте с водой.
12. Термит и лед
Вы когда-нибудь думали, что смешение огня и льда может привести к взрыву?
СВЯЗАННЫЕ: 11 ЛУЧШИХ ХИМИЧЕСКИХ КАНАЛОВ НА YOUTUBE
Вот что происходит, когда вы получаете небольшую помощь от Thermite, который представляет собой смесь алюминиевого порошка и оксида металла. Когда эта смесь воспламеняется, происходит экзотермическая окислительно-восстановительная реакция, т.е.е. химическая реакция, в которой энергия высвобождается в виде электронов, которые переходят между двумя веществами. Таким образом, когда термит помещается поверх льда и воспламеняется с помощью пламени, лед немедленно загорается, и выделяется большое количество тепла в виде взрыва. Однако нет какой-либо убедительной научной теории о том, почему термит вызывает взрыв. Но одно ясно из демонстрационного видео - не пробуйте это дома.
13.Осциллирующие часы Бриггса-Раушера
Реакция Бриггса-Раушера - одна из очень немногих колеблющихся химических реакций. Реакция дает ошеломляющий визуальный эффект за счет изменения цвета раствора. Для инициирования реакции смешивают три бесцветных раствора. Полученный раствор будет циклически менять цвет с прозрачного на янтарный в течение 3-5 минут и в итоге станет темно-синим. Три раствора, необходимые для этого наблюдения, - это разбавленная смесь серной кислоты (H 2 SO 4 ) и йодата калия (KIO 3 ), разбавленная смесь малоновой кислоты (HOOOCCH 2 COOH), моногидрат сульфата марганца. (МнСО 4 .H 2 O) и крахмал витекс и, наконец, разбавленный пероксид водорода (H 2 O 2 ).
14. Supercool Water
Вы можете не заморозить окружающую среду, как это сделала Эльза в фильме Frozen, но вы, безусловно, можете заморозить воду прикосновением к этому классному научному эксперименту. Эксперимент с супер холодной водой заключается в охлаждении очищенной воды до -24 ° C (-11 ° F). Охлажденную бутылку можно медленно вынуть и постучать по дну или по бокам, чтобы запустить процесс кристаллизации.Поскольку очищенная вода не имеет примесей, молекулы воды не имеют ядра для образования твердых кристаллов. Внешняя энергия, обеспечиваемая в виде крана или удара, заставит молекулы переохлажденной воды образовывать твердые кристаллы посредством зародышеобразования и запустит цепную реакцию по кристаллизации воды по всей бутылке.
15. Феррожидкость
Ферромагнитная жидкость состоит из наноразмерных ферромагнитных частиц, взвешенных в несущей жидкости, такой как органический растворитель или вода.Изначально обнаруженные Исследовательским центром НАСА в 1960-х годах в рамках исследования по поиску методов контроля жидкостей в космосе, феррожидкости при воздействии сильных магнитных полей будут создавать впечатляющие формы и узоры. Эти жидкости могут быть приготовлены путем объединения определенных пропорций соли Fe (II) и соли Fe (III) в основном растворе с образованием валентного оксида (Fe 3 O 4 ).
16. Гигантский пузырь из сухого льда
Сухой лед всегда является забавным веществом для разнообразных экспериментов.Если вам удастся найти немного сухого льда, попробуйте в этом эксперименте создать гигантский пузырь из простых материалов. Возьмите миску и наполовину наполните ее водой. Смочите жидкое мыло водой и перемешайте. Пальцами намочите края миски и добавьте в раствор сухой лед. Окуните полоску ткани в мыльную воду и протяните ее по всему краю миски. Подождите, пока пары сухого льда не задержатся внутри пузыря, который начнет постепенно расширяться.
17. Змея фараона
Змея фараона - это простая демонстрация фейерверка.Когда тиоцианат ртути воспламеняется, он распадается на три продукта, и каждый из них снова распадается на еще три вещества. Результатом этой реакции является растущий столб, напоминающий змею, с выделением пепла и дыма. Хотя все соединения ртути токсичны, лучший способ провести этот эксперимент - в вытяжном шкафу. Также существует серьезная опасность пожара. Однако самое простое решение - посмотреть видео, если у вас нет доступа к материалам.
18. Эффект Мейснера
Охлаждение сверхпроводника ниже температуры перехода сделает его диамагнитным.Это эффект, при котором объект будет отталкиваться от магнитного поля, а не тянуться к нему. Эффект Мейснера также привел к концепции транспортировки без трения, при которой объект может левитировать по рельсам, а не прикрепляться к колесам. Однако этот эффект также можно воспроизвести в лаборатории. Вам понадобится сверхпроводник и неодимовый магнит, а также жидкий азот. Охладите сверхпроводник жидким азотом и поместите сверху магнит, чтобы наблюдать левитацию.
19. Сверхтекучий гелий
Охлаждение гелия до достижения его лямбда-точки (-271 ° C) сделает его сверхтекучим гелием II. Эта сверхтекучая жидкость образует тонкую пленку внутри контейнера и будет подниматься против силы тяжести в поисках более теплого места. Тонкая пленка имеет толщину около 30 нм, в ней капиллярные силы превышают силу тяжести, которая удерживает жидкость в контейнере.
.