Какие продукты образуются при гидролизе белка
Типы гидролиза белка. Какие промежуточные и конечные продукты образуются при гидролизе белка?
Гидролиз – распад сложного вещества на более простые составные части, связанный с присоединением воды по месту разрыва связей. В зависимости от применяющегося катализатора различают кислотный, щелочной и ферментативный гидролиз.
Кислотный гидролиз осуществляется кипячением раствора белка в течение 16-92 часов, при температуре 1100с нормальным раствором кислоты. Щелочной гидролизпроизводится кипячением раствора белка в течение 4 – 8 часов, при 1100 с нормальным раствором NaOH. Ферментативный гидролиз происходит при участии ферментов протеиназ (пептидаз): трипсин, пепсин. В отличие от кислотного и щелочного гидролиза ферментативный гидролиз (протеолиз) наиболее специфичен, при нём ферменты расщепляют только определённые связи в белках. Окончание процесса гидролиза оценивают по двум признакам: а) отсутствие положительной биуретовой реакции на пептидные связи и б) окончание прироста концентрации аминогрупп и карбоксильных групп в гидролизате. Динамику прироста аминогрупп и карбоксильных групп определяют методом формольного титрования, связывая формальдегидом аминогруппы аминокислот, освобождающихся при гидролизе белка. Образовавшиеся при гидролизе аминокислоты идентифицируют методом хроматографического анализа, основанном на разных физико-химических свойствах аминокислот.
В организме гидролиз белка постоянно протекает в процессе как пищеварения, так и жизнедеятельности клеток под действием протеолитических ферментов. Действие протеолитических ферментов может быть разделено на две различные категории:
- ограниченный протеолиз, в котором протеаза специфически расщепляет одну или несколько пептидных связей в белке-мишени, что обычно приводит к изменению функционального состояния последнего: ферменты, например, при этом становятся активными, а прогормоны превращаются в гормоны;
- неограниченный или тотальный протеолиз, при котором белки распадаются до своих аминокислот.
При кислотном гидролизе белка разрушаются некоторые аминокислоты (триптофан подвергается полному разрушению, серин, треонин, цистин, тирозин, фенилаланин – частичному). При щелочномм гидролизе отмечается значительно более сильное разрушение аминокислот.
Продуктами полного гидролиза белков являются аминокислоты. В качестве промежуточных продуктов гидролиза образуются пептиды и полипептиды.
Биосинтез жирных кислот: этапы, последовательность реакций, ферменты.
Источником синтеза ЖК является малонил КоА, образующийся из ацетил КоА.
Образование малонил КоА из ацетил КоА.
Ацетил КоА поступает из матрикса митохондрий в цитоплазму с помощью карнитина и фермента ацетил КоА карнитинтрансферазы, которые переносят ацетильные остатки.
Стадии синтеза ЖК.
Синтез ЖК происходит на поверхности пальмитатсинтетазы- полфиерментный комплекс, состоящий из 7 ферментов. В центре комплекса -ацилпереносящий белок, который содержит две свободные SH-группы . А по периметру 6 остальных ферментов, каждый из которых выполняет определенные функции.
1)Перенос ацетила с ацетил КоА на синтетазу с участием ацетилтрансацилазы. Ацетил является затравкой в синтезе.
2)Перенос малоноила с малонил КоА на синтетазу с участием малонилтрансацилазы.
3)Конденсация ацетила с малонилом и декарбоксилирование образовавшегося продукта с участием бета-кетоацилсинтетаза.
4)Первое восстановление промежуточного продукта с участием НАДФН2.
5)Дегидратация промежуточного продукта с участием гидроксиацил-гидратазы.
6) Второе восстановление промежуточного продукта с участием НАДФН2.
Образуется бутирил, связанный с ферментом. Синтезированный бутирил переносится с участием ацетилртансацилазы на ту SH-группу, с которой вначале был связан затравочный ацетил. На освободившуюся SH-группу поступает новый малонильный остаток. Цикл синтеза повторяется.
гидролиз белка
Химия реакции
Если вы уже изучили гидролиз амидов в кислых условиях, вы обнаружите, что это, по сути, та же реакция. Это неудивительно, потому что то, что биологи и биохимики называют пептидной связью (например, в белках), химики называют амидной связью.
С амидом, подобным этанамиду, связь углерод-азот в амидной группе разрывается, и образуется карбоновая кислота:
Теперь представьте, что вы проделаете то же самое с простым дипептидом, состоящим из любых двух аминокислот.
Вместо ионов аммония вы получаете положительные ионы из групп -NH 2 , реагирующих с ионами водорода.
Вам нужен дополнительный ион водорода в уравнении (по сравнению с уравнением амида), чтобы реагировать с группой -NH 2 на левом конце дипептида - той, которая не участвует в пептидной связи.
Если масштабировать это до полипептида (белковой цепи), каждое из пептидных звеньев будет разорвано точно так же.Это означает, что вы получите смесь аминокислот, из которых состоит белок, хотя и в форме их положительных ионов из-за присутствия ионов водорода из соляной кислоты.
.Гидролиз | химическая реакция | Britannica
Hydrolysis , в химии и физиологии, реакция двойного разложения с водой в качестве одного из реагентов. Таким образом, если соединение представлено формулой AB , в которой A и B представляют собой атомы или группы, а вода представлена формулой HOH, реакция гидролиза может быть представлена обратимым химическим уравнением AB + HOH ⇌ A H + B OH.Реагенты, отличные от воды, и продукты гидролиза могут быть нейтральными молекулами, как при большинстве гидролизов с участием органических соединений, или ионными молекулами, как при гидролизах солей, кислот и оснований.
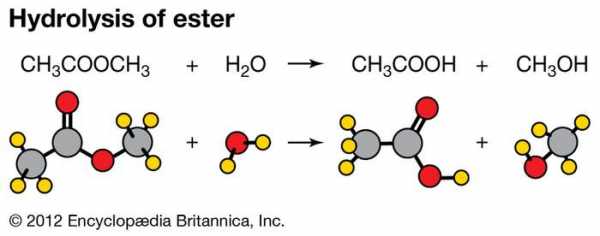 Реакция метилацетата и воды, демонстрирующая гидролиз сложного эфира.
Encyclopdia Britannica, Inc.
Реакция метилацетата и воды, демонстрирующая гидролиз сложного эфира.
Encyclopdia Britannica, Inc. Подробнее по теме
химическая реакция: сольволиз и гидролиз
Реакция сольволиза - это реакция, в которой растворитель также является реагентом.Реакции сольволиза обычно называют в честь конкретного растворителя - для ...
Гидролиз с участием органических соединений можно проиллюстрировать на примере реакции воды со сложным эфиром карбоновой кислоты; все такие сложные эфиры имеют общую формулу R CO ― O R ', в которой R и R ' являются объединяющими группами (например, если R и R 'оба представляют собой метильную группу, CH 3 , сложный эфир - метилацетат).Гидролиз включает несколько стадий, самая медленная из которых - образование ковалентной связи между атомом кислорода молекулы воды и атомом углерода сложного эфира. На последующих этапах, которые происходят очень быстро, углерод-кислородная связь сложного эфира разрывается, и ионы водорода отделяются от исходной молекулы воды и присоединяются к возникающей молекуле спирта. Вся реакция представлена уравнением R CO ― O R ′ + H 2 O → R CO OH + R ′ ―OH, в которой R CO ― OH обозначает молекулу карбоновой кислоты, R 'OH обозначает молекулу спирта, а пунктиры обозначают ковалентные связи, которые разрываются или образуются в ходе реакции.
Характерной чертой гидролиза сложных эфиров и большинства других органических соединений является то, что третье вещество, обычно кислота или основание, увеличивает скорость, с которой происходит химическое изменение. В биохимическом процессе пищеварения ферменты, выделяемые пищеварительным трактом, катализируют гидролиз сложных молекул в формы, которые могут ассимилироваться организмами. Белки разлагаются на аминокислоты, жиры - на жирные кислоты и глицерин, а крахмалы и сложные сахара - на глюкозу и другие простые сахара; ферменты, такие как липазы, амилазы и протеиназы, катализируют гидролиз жиров, углеводов и белков соответственно.
Гидролиз с участием ионных соединений может быть проиллюстрирован химическими изменениями, происходящими в водном растворе соли ацетата натрия. В растворе ионные составляющие соли (ацетат-ион и ион натрия) разделяются; Молекулы воды соединяются с ионами ацетата с образованием ионов уксусной кислоты и гидроксида. Уксусная кислота обратимо диссоциирует на ионы ацетата и ионы водорода, но только в очень небольшой степени, так что ионный состав раствора в основном состоит из ионов натрия и гидроксида.Следовательно, раствор проявляет основные свойства (т. Е. Окрашивает красную лакмусовую бумажку в синий цвет).
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодня .8 признаков и симптомов белковой недостаточности
Не у всех одинаковая потребность в белке. Это зависит от многих факторов, включая массу тела, мышечную массу, физическую активность и возраст.
Возможно, масса тела является наиболее важным фактором, определяющим потребность в белке. В результате рекомендации обычно представлены в граммах на каждый фунт или килограмм веса тела.
Рекомендуемая суточная доза (RDA) составляет 0,4 грамма протеина на каждый фунт массы тела (0.8 грамм на кг). По оценке ученых, этого должно хватить для большинства людей.
Это соответствует 66 граммам белка в день для взрослого человека с весом 165 фунтов (75 кг).
Для спортсменов Американский колледж спортивной медицины рекомендует ежедневное потребление белка в диапазоне от 0,5 до 0,6 грамма на каждый фунт массы тела (1,2–1,4 грамма на кг), что должно быть достаточно для поддержания мышц и восстановления после тренировок (37). .
Однако ученые не согласны с тем, сколько достаточно.Ежедневная рекомендация Международного общества спортивного питания составляет 0,9 грамма белка на фунт веса тела (2 грамма на кг) для спортсменов (38).
Как и спортсмены, пожилые люди, похоже, имеют более высокие потребности в белке.
В то время как RDA в настоящее время одинакова для пожилых и молодых людей, исследования показывают, что она занижена и должна быть увеличена до 0,5–0,7 грамма на фунт массы тела (1,2–1,5 грамма на кг) для пожилых людей (39, 40) .
Проще говоря, если вы старше или физически активны, ваши ежедневные потребности в белке, вероятно, выше, чем текущая дневная норма потребления, равная 0.4 грамма на фунт веса тела (0,8 грамма на кг).
К самым богатым источникам белка относятся рыба, мясо, яйца, молочные продукты и бобовые.
Резюме: Рекомендуемая суточная норма белка составляет 0,4 грамма на фунт (0,8 грамма на кг). Однако исследования показывают, что требования могут быть выше для спортсменов и пожилых людей. Насколько больше - предмет споров..
белков | Определение, структура и классификация
Белок , очень сложное вещество, которое присутствует во всех живых организмах. Белки имеют большую питательную ценность и непосредственно участвуют в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йенсом Якобом Берцелиусом, который в 1838 году ввел в обращение термин белок , слово, производное от греческого prōteios , что означает «удерживать первое место».”Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
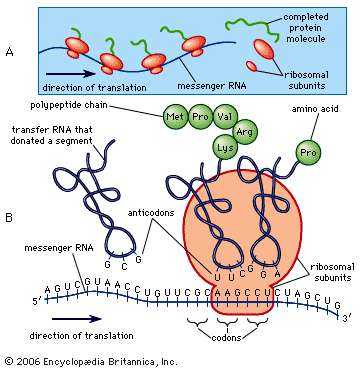 Синтез белка Синтез белка. Encyclopædia Britannica, Inc.
Синтез белка Синтез белка. Encyclopædia Britannica, Inc. Популярные вопросы
Что такое белок?
Белок - это встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями.Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для дальнейшего использования в животных. Когда животное потребляет избыток белков, они превращаются в жиры (глюкозу или триглицериды) и используются для снабжения энергией или создания энергетических запасов. Если животное не потребляет достаточное количество белка, организм начинает расщеплять богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной деятельности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки, и они помогают связывать клетки вместе в ткани. Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Белковая молекула очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных вместе в длинные цепочки, подобно тому, как бусинки расположены на нити. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность. Хотя пока невозможно объяснить все функции белка на основе его аминокислотной последовательности, установленные корреляции между структурой и функцией можно отнести к свойствам аминокислот, из которых состоят белки.
 пептид Молекулярная структура пептида (небольшого белка) состоит из последовательности аминокислот. © raimund14 / Fotolia
пептид Молекулярная структура пептида (небольшого белка) состоит из последовательности аминокислот. © raimund14 / Fotolia Растения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни. Растения могут расти в среде, содержащей неорганические питательные вещества, обеспечивающие азот, калий и другие вещества, необходимые для роста. Они используют углекислый газ, содержащийся в воздухе, в процессе фотосинтеза для образования органических соединений, таких как углеводы.Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений низкое, очень большое количество растительного материала требуется животным, таким как жвачные животные (например, коровы), которые едят только растительный материал для удовлетворения своих потребностей в аминокислотах. Нежвачные животные, в том числе люди, получают белки в основном от животных и продуктов их переработки, например мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой, богатой белком пищи ( см. питание человека).
 бобовые; amino acid Бобовые, такие как фасоль, чечевица и горох, богаты белком и содержат много незаменимых аминокислот. © Elenathewise / Fotolia
бобовые; amino acid Бобовые, такие как фасоль, чечевица и горох, богаты белком и содержат много незаменимых аминокислот. © Elenathewise / Fotolia Содержание белка в органах животных обычно намного выше, чем в плазме крови. Например, мышцы содержат около 30 процентов белка, печень - 20-30 процентов, а эритроциты - 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды.Количество свободных аминокислот и пептидов у животных намного меньше количества белка; Белковые молекулы продуцируются в клетках путем поэтапного выравнивания аминокислот и попадают в жидкости организма только после завершения синтеза.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодняВысокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые из наиболее важных белков, таких как ферменты и гормоны, присутствуют в очень малых количествах.Важность белков в основном связана с их функцией. Все идентифицированные ферменты являются белками. Ферменты, которые являются катализаторами всех метаболических реакций, позволяют организму накапливать химические вещества, необходимые для жизни, - белки, нуклеиновые кислоты, углеводы и липиды, - превращать их в другие вещества и разрушать их. Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регуляторными функциями. У всех позвоночных респираторный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела.Большая группа структурных белков поддерживает и защищает структуру тела животного.
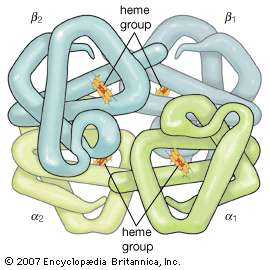 гемоглобин Гемоглобин - это белок, состоящий из четырех полипептидных цепей (α 1 , α 2 , β 1 и β 2 ). Каждая цепь присоединена к группе гема, состоящей из порфирина (органическое кольцеобразное соединение), присоединенного к атому железа. Эти комплексы железо-порфирин обратимо координируют молекулы кислорода, что напрямую связано с ролью гемоглобина в переносе кислорода в крови. Encyclopædia Britannica, Inc. .
гемоглобин Гемоглобин - это белок, состоящий из четырех полипептидных цепей (α 1 , α 2 , β 1 и β 2 ). Каждая цепь присоединена к группе гема, состоящей из порфирина (органическое кольцеобразное соединение), присоединенного к атому железа. Эти комплексы железо-порфирин обратимо координируют молекулы кислорода, что напрямую связано с ролью гемоглобина в переносе кислорода в крови. Encyclopædia Britannica, Inc. .









