Какие продукты можно получить из этилена
Продукты, получаемые из пропилена и этилена
Циклопентан относительно термически стабилен он не подвергается дегидрированию нри нормальных температурах крекинга, а при более жестких условиях углерод-углеродная связь расщепляется с разрывом кольца [50—53]. Циклогексан начинает разлагаться при 490—510° С, образуя большие количества водорода, этилена, бутадиена [54], бензола [55] пропилен не получается [56]. Циклогексен, по-видимому, является промежуточным продуктом, из которого затем образуются бензол и водород или бутадиен и этилен [55]. Последний вариант реакции протекает почти количественно при 800° С [56] в продуктах реакции почти нацело отсутствует циклогексадиен [57]. Нет доказательств и в пользу предположения о возможности изомеризации циклогексана в метилциклопентан при термическом крекинге [56]. [c.301]Олефины, содержащиеся в продуктах крекинга и особенно в крекинг-газах, являются хорошим и легко доступным для производства сырьем. Для увеличения ресурсов олефинового сырья парафины или более тяжелые фракции специально подвергают крекированию (пиролизу). Таким образом, этилен получается в результате крекинга различных газов С2—С4 (этан, пропан, бутан) и жидких фракций (газойль, лигроин и мазут). Пропилен получается при термическом и каталитическом крекинге лигроинов и газойлей, а также из пропана и бутана. [c.577]
Кубовые остатки деэтанизатора, содержащие углеводороды С., и более тяжелые продукты, направляются в депропанизатор здесь происходит отделение пропан-пропиленовой фракции. Температура в кубе депропанизатора 104 °С, температура верха 25—30 С, давление около 1,1 МПа. Кубовые остатки из депропанизатора самотеком поступают на питание дебутанизатора, а верхний продукт— пропан-пропиленовая фракция — после осушки подается в колонну фракционирования пропилена. Выделение чистого пропилена достигается при температуре в кубе пропиленовой колонны 46—48 °С и давлении 1,6—1,8 МПа. Пропилен отбирается из верха колонны, а кубовая жидкость направляется на извлечение из нее аллена и метилацетилена. Колонна дебутанизации предназначена для выделения бутан-бутиленовой фракции. Температура в кубе дебутанизатора 114—119 °С, температура верха 40—42 °С, давление около 5 МПа. Из верха дебутанизатора отбирается богатая бутадиеном и бутиленами фракции С4. Кубовые остатки дебутанизатора — пиролизный бензин — направляются на гидрирование, а затем на выделение бензола. Основные продукты установки пиролиза — этилен и пропилен — получаются полимеризационной чистоты. Содержание основного продукта в товарном этилене 99,9 % (об.), в пропилене 99,8 % (об.). [c.47]
Давно известный метод автотермического дегидрирования этана в этилен (рис. 12) усовершенствован в настоящее время для дегидрирования природных газов [93]. В реакторе с керамической футеровкой теплоносителем являются фарфоровые шарики. Газовая смесь из этана и пропана вводится в реактор вместе с чистым кислородом и сжигается не до конца при 850—900 °С. Давление 0,6 кгс/см2, время контакта 1с. При этом получаются следующие продукты этилен, пропилен, метан, окись и двуокись углерода. [c.35]
Исходным сырьем для синтеза полиолефинов служат непредельные углеводороды — этилен, пропилен, бутилен и другие высшие олефины, получающиеся при термической переработке нефти,, а также переработке природного газа. Выход олефинов существенно зависит от условий проведения процесса. Максимальное количество олефинов образуется при термическом крекинге нефти, сущность которого заключается в расщеплении высших углеводородов на углеводороды с меньшим молекулярным весом. Процесс проводится при температуре 450—550°С и давлении 5—50 ат. Он сопровождается разложением высших углеводородов с образованием свободных радикалов. Поэтому наряду с деструкцией происходит рекомбинация свободных радикалов и получаются продукты более сложного строения. Например, при крекинге пропана получается пропилен, этилен, метан и высшие углеводороды [c.12]
Из более сложных углеводородов наряду с этиленом и пропиленом в качестве конечных продуктов получаются углеводороды С4 и выше. [c.90]
НЕФТЯНЫЕ ГАЗЫ — смесь различных газообразных углеводородов, растворенных в нефти, выделяющихся в процессе ее добычи и перегонки. Газы крекинга нефти, состоящие нз предельных и непредельных углеводородов (этилен, ацетилен и др.), также относят к Н. г. Н. г. применяются как топливо н как сырье для химической промышленности. Путем химической переработки из Н. г. получают пропилен, бути-лены, бутадиен и др., которые используют в производстве пластмасс, каучуков и других продуктов органического синтеза. [c.174]
Пиролиз бутанов протекает в тех же условиях, что и пиролиз пропана. Продуктами разложения н-бутана являются бутен-1, бу-тен-2, водород, метан, этан, этилен и пропилен. Температура выше 700° С способствует образованию этилена при более низкой температуре получается пропилен. [c.75]
В связи с требованиями, предъявляемыми производителями полимерных материалов и ряда продуктов органического синтеза, этилен и пропилен должны быть получены высокой степени чистоты. [c.811]
Эта реакция проводится путем пропускания паров этилового спирта через контактные аппараты (обогреваемые реторты), заполненные катализатором, нри 360—370° С и остаточном давлении 10 мм рт. ст. Через каждые 15—17 часов ддя выжига углистых отложений катализатор регенерируется горячим воздухом при 450—490° С. Ввиду того, что реакция протекает по сложному пути с образованием ряда промежуточных продуктов, наряду с бутадиеном в качестве побочных продуктов образуются бутилены, пропилен, этилен, водород и прочие вещества, число которых доходит до 30. После ректификации продуктов реакции получается 90—93%-ный бутадиен, содержащий в качестве примесей бутилены. [c.178]
В высокотемпературных процессах кроме деструктивного нитрования побочно происходит крекинг углеводородов, продуктами которого являются низшие парафины и олефины. Так, при нитровании пропана получаются метан, этилен, пропилен [c.475]
В странах, в которых мало природного газа (Западная Европа, Англия), этилен приходится производить крекингом жидких нефтяных фракций. При этом образуются пропилен и бутилены в количестве, почти равном количеству этилена. Одновременно в качестве побочных продуктов
Simple English Wikipedia, бесплатная энциклопедия
Этилен или Этен представляет собой химическое соединение с двумя атомами углерода и четырьмя атомами водорода в каждой молекуле. Эти молекулы соединены двойной связью, которая превращает его в углеводород. Он очень важен в промышленности и даже используется в биологии в качестве гормона. [1] Это также наиболее производимый химикат. Около 75 миллионов тонн его производится каждый год с 2005 года. [2] Его наибольшее применение - производство полиэтилена.
С 1795 года этилен назывался олефиантным газом или газом для производства нефти . Это произошло потому, что он пришел вместе с хлором, чтобы произвести масло голландских химиков .
В 1866 году немецкий химик Август Вильгельм фон Хофманн разработал систему обозначения углеводородов. Суффиксы -ane, -ene, -ine, -one и -une использовались для обозначения углеводородов с на 0, 2, 4, 6 и 8 атомов водорода меньше, чем у алкана, из которого он произошел. [3] Благодаря этой системе этилен превратился в этен.
В 1979 году ИЮПАК решил, что этилен останется этиленом.
Этилен производят в химической промышленности путем парового крекинга. Некоторые части этиленового завода могут быть:
- Печи парового крекинга;
- Системы рекуперации тепла;
- Система рециркуляции пара;
- Система сжатия крекинг-газа;
- Система удаления кислых газов;
На заводе по производству этилена есть и другие системы. Перечисленные выше системы были наиболее важными системами на заводе по производству этилена.
Поскольку при производстве этилена требуется много энергии, люди, производящие этилен, очень стараются не допускать выхода тепла газов из печей.
.Этилен- wikiwand
Для более быстрой навигации этот iframe предварительно загружает страницу Wikiwand для Ethylene .
Подключено к:
{{:: readMoreArticle.title}}Из Википедии, свободной энциклопедии
{{bottomLinkPreText}} {{bottomLinkText}} Эта страница основана на статье в Википедии, написанной участники (читать / редактировать).Текст доступен под CC BY-SA 4.0 лицензия; могут применяться дополнительные условия.
Изображения, видео и аудио доступны по соответствующим лицензиям.
Спасибо за жалобу на это видео!
Пожалуйста, помогите нам решить эту ошибку, написав нам по адресу support @ wikiwand.comСообщите нам, что вы сделали, что вызвало эту ошибку, какой браузер вы используете и установлены ли у вас какие-либо специальные расширения / надстройки.
Спасибо! .
Этилен Что такое этилен? Что трескается? Почему мы делаем это?
Презентация на тему: «Этилен Что такое этилен? Что такое крекинг? Почему мы это делаем?» - стенограмма презентации:
1 Этилен Что такое этилен? Что трескается? Почему мы делаем это?
2 Этилен Этилен - ненасыщенный углеводород.Состав:? Формула :? Форма :? Его получают из нефти. (сырая нефть)
3 Фракционная перегонка
4 Продукты фракционной перегонки Сырая нефть содержит в основном крупные молекулы. В - Почему это проблема? Большие молекулы Маленькие молекулы Средние молекулы
5 P Большая доля длинных цепей представляет собой проблему, потому что существует небольшой спрос на фракции с длинной цепью (например: ____), но ОГРОМНЫЙ спрос на короткие цепи (например: _____) Большие молекулы Маленькие молекулы Средние молекулы Продукты фракционной перегонки
6 Растрескивание Одним из решений этого является «раскол» длинноцепочечных молекул на короткие.Доступны два варианта: 1) термический крекинг (с использованием очень высоких температур для разрыва связей) 2) каталитический крекинг (с использованием катализатора для разрыва связей при более низкой температуре)
7 Растрескивание Представьте, что у вас есть завод по производству трещин. Думая о времени, безопасности, энергии и стоимости, обосновывайте предпочтение каталитического крекинга перед термическим крекингом. 5 минут
8 Каталитический крекинг Крупные углеводороды расщепляются на более мелкие молекулы с помощью тепла и катализатора.Полученные небольшие молекулы затем разделяются дистилляцией. Установка каталитического крекинга Тепло для испарения Давление в дистилляционной башне Большие молекулы Меньшие молекулы Молекулы распадаются
9 Каталитический крекинг Используя наборы молимод, проведите крекинг декана для получения этилена. Заполните недостающие пробелы на следующем слайде. Вы должны добавить уравнение сбалансированного символа.
10 Каталитический крекинг В установке каталитического крекинга длинноцепочечные молекулы расщепляются или «раскалываются».Пример такой реакции: + этилен Используется для получения 1) _________ 2) __________ Катализатор теплового давления Используется как ______ декан ______
11 Причины каталитического крекинга Q) Оценить важность каталитического крекинга для нефтяной и полимерной промышленности. (5 минут)
12 Причины каталитического крекинга A) Вы должны были упомянуть: 1) производство короткоцепочечных алканов (полезно) 2) сокращение избыточных длинноцепочечных фракций.3) получение полезных алкенов, используемых для получения полимеров.
.алкенов | Факты, типы и свойства
Основные факты и резюме
- Алкены - это углеводороды, содержащие двойную углерод-углеродную связь.
- Все алкены с 4 или более атомами углерода в них имеют структурную
- Двойная связь углерод-углерод не допускает вращения вокруг себя ( цис-транс-изомерия ).
- Общие электроны в двойной связи называются пи-электронами, и они создают связь пи .
- Электроны в пи-связи могут свободно перемещаться в любом месте этой заштрихованной области и могут свободно перемещаться от одной половины к другой.
- Достаточно открытые электроны в пи-связи особенно уязвимы для атак со стороны вещей, несущих некоторый положительный заряд. Они называются
Алкены - это углеводороды, содержащие двойную углерод-углеродную связь. Двойная связь углерод-углерод является одновременно важной структурной единицей и важной функциональной группой в органической химии. На форму органической молекулы влияет присутствие этой связи, а двойная связь является местом большинства химических реакций, которым подвергаются алкены.Некоторые типичные алкены включают изобутилен (промышленный химикат), пинен (ароматная жидкость, полученная из сосен) и фарнезен (встречающийся в природе алкен с тремя двойными связями).
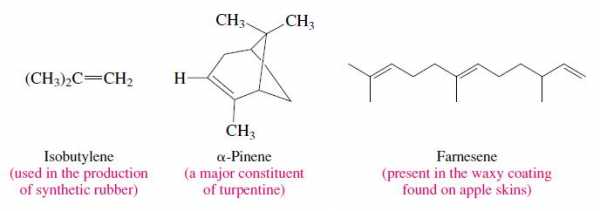
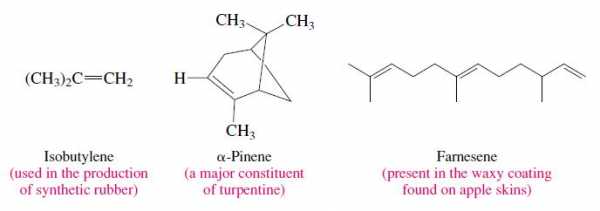
Мы даем алкенам названия IUPAC, заменяя окончание -ан, соответствующего алкана, на -ен. Двумя простейшими алкенами являются этен, и пропен. Оба они также хорошо известны под своими общими названиями этилен, и пропилен.Этилен является приемлемым синонимом этена в системе ИЮПАК. Пропилен, изобутилен, и другие общепринятые названия, оканчивающиеся на -илен , не являются приемлемыми названиями IUPAC.
Эта двойная связь углерод-углерод изменяет физические свойства алкенов. При комнатной температуре алкены существуют во всех трех фазах: твердой, жидкой и газовой. Точки плавления и кипения алкенов аналогичны температурам плавления алканов, однако изомеры цисалкенов имеют более низкие температуры плавления, чем транс-изомеры.Алкены проявляют слабое диполь-дипольное взаимодействие.
Изомерия в алкенах
Все алкены с 4 или более атомами углерода в них обнаруживают структурную изомерию. Это означает, что для каждой молекулярной формулы вы можете нарисовать две или несколько различных структурных формул. Например, для C 4 H 8 нетрудно найти эти три структурных изомера:
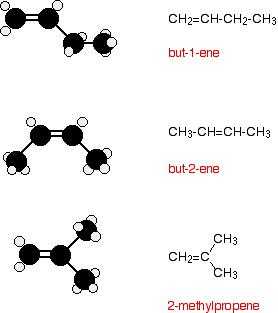
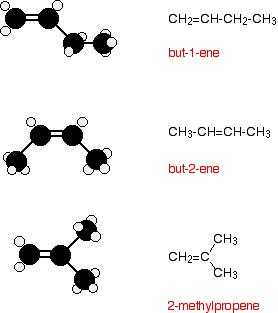
Однако есть еще один изомер.Бут-2-ен также проявляет геометрическую изомерию.
Геометрическая (цис-транс) изомерия
Двойная связь углерод-углерод не допускает вращения вокруг себя. Это означает, что группы CH 3 на любом конце молекулы могут быть заблокированы либо на одной стороне молекулы, либо напротив друг друга. Их называют цис-бут-2-еном (где группы находятся на одной стороне) или транс-бут-2-еном (когда они находятся на противоположных сторонах).
Цис-бут-2-ен также известен как (Z) -бут-2-ен; транс-бут-2-ен также известен как (E) -бут-2-ен.
Циклоалкены
A циклоалкен или циклоолефин представляет собой тип алкенового углеводорода, который содержит замкнутое кольцо из атомов углерода, но не имеет ароматических свойств. Некоторые циклоалкены, такие как циклобутен и циклопентен, можно использовать в качестве мономеров для получения полимерных цепей. Из-за геометрических соображений меньшие циклоалкены почти всегда являются изомерами цис , и термин цис , как правило, не используется в названиях.
В более крупных кольцах (примерно из 8 атомов) может иметь место цис - транс изомерия двойной связи. Циклопропен дестабилизируется угловой деформацией. Циклобутен, конечно, имеет меньшую угловую деформацию, чем циклопропен, а угловая деформация циклопентена, циклогексена и высших циклоалкенов незначительна. До сих пор мы представляли циклоалкены структурными формулами, в которых двойные связи имеют цис-конфигурацию.

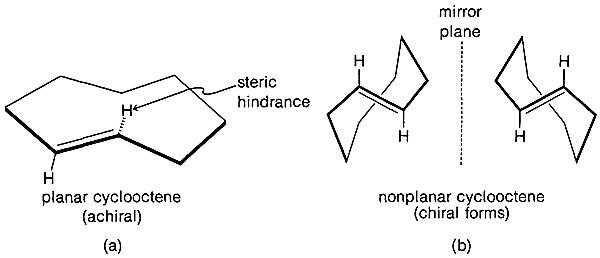
Физические свойства алкенов
Температура кипения каждого алкена очень похожа на точку кипения алкана с таким же числом атомов углерода.Этен, пропен и различные бутены являются газами при комнатной температуре. Все остальное, с чем вы, вероятно, столкнетесь, - это жидкости.
В каждом случае алкен имеет точку кипения, которая на небольшое количество градусов ниже, чем соответствующий алкан. Единственные задействованные притяжения - это силы дисперсии Ван-дер-Ваальса, которые зависят от формы молекулы и количества содержащихся в ней электронов. Каждый алкен имеет на 2 электрона меньше, чем алкан с таким же числом атомов углерода. Алкены практически не растворяются в воде, но растворяются в органических растворителях.
Связь в алкенах
Нам просто нужно взглянуть на этен, потому что то, что верно для C = C в этене, будет одинаково верно для C = C в более сложных алкенах. Этен часто моделируют так:
Двойная связь между атомами углерода - это, конечно, две пары общих электронов. На диаграмме не показано, что две пары не идентичны друг другу. Одна из пар электронов удерживается на линии между двумя ядрами углерода, как и следовало ожидать, а другая удерживается выше и ниже плоскости молекулы на молекулярной орбитали.Молекулярная орбиталь - это область пространства внутри молекулы, где есть высокая вероятность найти определенную пару электронов.
На этой диаграмме линия между двумя атомами углерода представляет собой нормальную связь - пара общих электронов лежит на молекулярной орбитали на линии между двумя ядрами, где, как вы ожидаете, они должны находиться. Такой вид облигации называется сигма-облигацией.
Другая пара электронов находится где-то в заштрихованной части выше и ниже плоскости молекулы.Эта связь называется пи-связью. Электроны в пи-связи могут свободно перемещаться в любом месте этой заштрихованной области и могут свободно перемещаться от одной половины к другой.
Пи-электроны не так полностью контролируются ядрами углерода, как электроны в сигма-связи, и, поскольку они лежат обнаженными выше и ниже остальной части молекулы, они относительно открыты для атак со стороны других объектов.
Реакции алкенов
Как и любые другие углеводороды, алкены горят на воздухе или в кислороде, но эти реакции не важны.Алкены слишком ценны, чтобы тратить их таким образом. Все важные реакции сосредоточены на двойной связи. Обычно пи-связь разрывается, и электроны из нее используются для соединения двух атомов углерода с другими объектами. Алкены вступают в реакции присоединения. Например, используя общую молекулу X-Y
Сильно обнаженные электроны в пи-связи особенно уязвимы для атак со стороны вещей, несущих некоторый положительный заряд. Их называют электрофилами.
Ссылки и дополнительная информация:
https: // www.khanacademy.org/science/organic-chemistry/alkenes-alkynes/
https://www.toppr.com/bytes/
https://www.slideserve.com/search/presentations/alkenes
http://www.chemistryrocks.net
https://chem.libretexts.org/Textbook_Maps/Organic_Chemistry/Supplemental_Modules_(Organic_Chemistry)/Alkanes/
«Органическая химия», Фрэнсис А. Кэри, ISBN 0-07-117499-0
.