Исследование продуктов на содержание крахмала с помощью йода 3 класс
План-конспект занятия по окружающему миру (3 класс) на тему: конспект занятия кружка "Лаборатория открытий" по теме:"Крахмал. Свойства. Определение продуктов, в состав которых входит крахмал"
Конспект открытого занятия кружка «Лаборатория открытий» (общеинтеллектуальное направление),
проведенного 22марта 2018г. в 3Вклассе МКОУ СОШ №15
Тема: Крахмал. Свойства. Определение продуктов, в состав которых входит крахмал.
Цель: 1. Познакомиться с крахмалом, изучить его свойства, научиться определять наличие крахмала в веществах с помощью йода
- Развивать навыки работы в группе, формировать навыки экспериментальной деятельности
- Воспитывать стремление к здоровому образу жизни.
Оборудование: - крахмал
- пипетки
- стаканы (с холодной водой – у детей, с горячей – только у учителя)
- стаканы с лупой
- металлические ложки
- тарелки с кусочками продуктов (хлеб, картофель сырой, морковь, свекла, апельсин, яблоко, лимон, конфета, макароны, рис, крупа гречихи, лук репчатый, груша, кукуруза)
- флакон с йодом
- таблицы для фиксирования результатов исследования
Форма занятия: групповая
Ход занятия
I. Организационный момент:
Добро пожаловать на занятие нашего кружка «Лаборатория открытий»
Мир полон чудесных задачек и тайн
И ты их разгадаешь, поверь.
В мир новых открытий загадок природы
Мы приоткроем дверь…
II. Определение темы и цели занятия:
-Мы недавно с вами вырастили растение фасоль, наблюдали за его развитием. Откуда небольшой росточек черпал энергию для своего роста? В чем уникальность всех растений? (Ответы детей: -растения в зелёных листьях на свету из углекислого газа, воды и растворенных в ней минеральных солей готовят себе питательные вещества. Так они обеспечивают себя энергией для роста и развития)
- А как называется вещество, которое образуется и накапливается во многих растениях? (Ответ детей: Крахмал)
- Цель занятия: сегодня мы изучим это вещество, опишем его свойства, научимся определять его наличие в продуктах питания.
III. Опыт №1. Определение свойств крахмала
Рассмотрите вещество через лупу.
-На что похоже? (На зернистый порошок)
- Какого он цвета? (Белого)
- Попробуйте на вкус. Имеет ли он вкус? (Безвкусный)
- Попробуйте потереть его пальцами. Что вы ощущаете? (Поскрипывание. Предполагают причину появления звука- «трение частиц»)
- Возьмите ложку крахмала и размешайте его в стакане с водой. Что происходит? (Порошок не растворяется)
- Посмотрите на крахмал в стакане с горячей водой. Что с ним произошло? (Он растворился и превратился в клейстер). Где мы используем это свойство крахмала? (При приготовлении киселей, соусов, подливок, клея)
На основании своих экспериментов, записей, которые вы делали в ходе работы, составьте рассказ о крахмале. ( Примерный ответ: Крахмал- безвкусный порошок белого цвета, нерастворимый в воде. Это зернистый порошок, при сжатии в руке он издает характерный звук «скрип», вызванный трением частиц. В горячей воде он растворяется и превращается в клейстер)
- А теперь познакомимся с содержанием статьи о крахмале, найденной в сети Интернет:
Статья:
Крахмал – безвкусный порошок белого цвета, нерастворимый в воде. При сжатии порошка крахмала в руке он издаёт характерный звук «скрип», вызванный трением частиц.В горячей воде растворяется и превращается в клейстер.
Крахмал – углевод, накапливающийся во многих растениях; он составляет около 70% питания человечества. Растения и животные преобразуют крахмал в глюкозу, которая служит источником энергии.
- Что нового для себя о крахмале вы узнали из этой статьи? (Ответ: крахмал служит источником энергии и для растений, и для человека и животных)
- Вывод детей: для того, чтобы быть энергичными, нужно употреблять в пищу продукты, содержащие крахмал.
- А как определить наличие крахмала в продуктах? (Ответы детей: мы изучали состав семян и узнали, что определить наличие крахмала можно с помощью йода. Если место, куда капнули йод, посинело, значит, в этом продукте содержится крахмал. Если это место стало коричневым, значит, этот продукт не содержит крахмала.)
IV. Опыт №2. Определение продуктов, в состав которых входит крахмал
Дети проводят исследования в группах, результаты заносят в таблицу.
№ п/п | Название продукта | Содержит крахмал – «+» Не содержит крахмал – «-» |
1 | Хлеб | |
2 | Макароны | |
3 | Морковь | |
4 | Свекла | |
5 | Картофель | |
6 | Лук | |
7 | Яблоко | |
8 | Груша | |
9 | Конфета | |
10 | Апельсин, лимон | |
|
11 | Рис | |
12 | Гречка | |
13 | Кукуруза |
V. Отчет по результатам исследования, выводы
- Крахмал встречается: в зерновых (крупы, макароны, кукуруза), в картофеле, хлебе, конфетах.
- Не содержится: во фруктах и овощах, кроме картофеля.
- Можно ли много употреблять в пищу продуктов, содержащих крахмал? Предположения детей, обоснования.
Правильный ответ: нет, так как большое количество крахмала (углеводов) ведет к образованию жира. Все хорошо в меру. Питайтесь правильно и будьте здоровы!
Исследование концентрации HPAM - крахмал-кадмиевый йодный метод
[1] СКОГГИНС М. В. , МИЛЛЕР Д. В. Определение водорастворимых полимеров, содержащих первичные амидные группы, с использованием метода крахмал-трииодид [J] .Soc.Petro1.Eng. [J] 1979,19 (3) : 151 ~ 154.
DOI: 10.2118/7664-па
[2] Junming Hu , Qingong He.Иодно-крахмальное колориметрическое определение следов полиакриламида [J] .Petrochemical Technology , 1983–12 (7) 430 434.
[3] Шигуан Ян , Линь Ян , Сяотун Рао.Определение концентрации полиакриламида - усовершенствование колориметрического метода йод-крахмал [J] Журнал Southwest Petroleum University , 1992,14 (2) : 105 ~ 109.
[4] Бейлинг Конг Исследование гидролиза полиакриламидов в условиях высоких пластовых температур [J] Разведка и разработка нефти , 1998 )25 (6) 67 ~ 69.
.крахмал | Определение, формула, применение и факты
Крахмал , белый гранулированный органический химикат, который вырабатывается всеми зелеными растениями. Крахмал - это мягкий белый безвкусный порошок, нерастворимый в холодной воде, спирте или других растворителях. Основная химическая формула молекулы крахмала: (C 6 H 10 O 5 ) n . Крахмал представляет собой полисахарид, содержащий мономеры глюкозы, соединенные α 1,4 связями. Самая простая форма крахмала - линейная полимерная амилоза; амилопектин - это разветвленная форма.
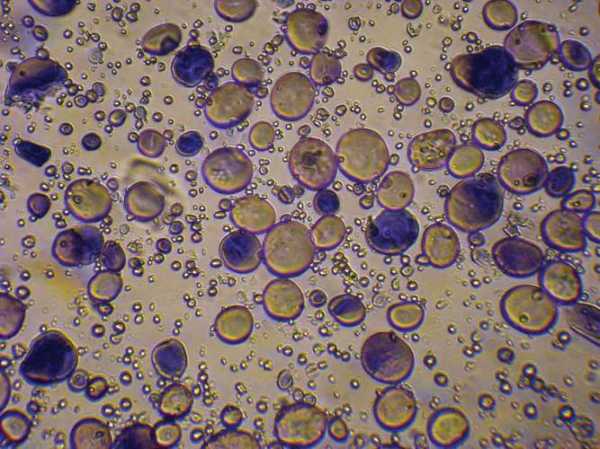 гранулы крахмала Гранулы пшеничного крахмала, окрашенные йодом. Киселов Юрий
гранулы крахмала Гранулы пшеничного крахмала, окрашенные йодом. Киселов Юрий 
Британская викторина
Человеческое тело
Какова средняя температура здорового человека в градусах Цельсия?
Крахмал производится зелеными листьями растений из избытка глюкозы, образующейся во время фотосинтеза, и служит растениям в качестве резервного источника питания.Крахмал хранится в хлоропластах в виде гранул и в таких органах хранения, как корни маниоки; клубень картофеля; сердцевина стебля саго; и семена кукурузы, пшеницы и риса. При необходимости крахмал расщепляется в присутствии определенных ферментов и воды на составляющие его мономерные единицы глюкозы, которые диффундируют из клетки для питания тканей растения. У людей и других животных крахмал из растений расщепляется на составляющие его молекулы сахара, которые затем снабжают ткани энергией.
 органические продукты Органический молодь картофеля. © Brent Hofacker / Fotolia
органические продукты Органический молодь картофеля. © Brent Hofacker / Fotolia Большая часть коммерческого крахмала производится из кукурузы, хотя также используются пшеничный, тапиоковый и картофельный крахмал. Товарный крахмал получают путем измельчения или измельчения крахмалосодержащих клубней или семян с последующим смешиванием мякоти с водой; Полученная паста очищается от оставшихся примесей и затем сушится. Помимо основного пищевого использования, крахмалы используются в пивоварении и в качестве загустителей в выпечке и кондитерских изделиях.Крахмал используется в производстве бумаги для увеличения прочности бумаги, а также для проклейки поверхности бумаги. Крахмал используется при производстве гофрированного картона, бумажных пакетов и коробок, а также гуммированной бумаги и ленты. Большое количество крахмала также используется в текстильной промышленности в качестве проклейки основы, которая придает прочность нити во время ткачества.
.Крахмал и микробные α-амилазы: от концепций до биотехнологических применений
Амилазы - это класс ферментов, способных переваривать эти гликозидные связи, обнаруженные в крахмале. Амилазы могут быть получены из множества источников. Они присутствуют во всех живых организмах, но ферменты различаются по активности, специфичности и требованиям от вида к виду и даже от ткани к ткани в одном и том же организме. Амилазы, переваривающие сырой крахмал, вырабатываются множеством живых организмов, от микроорганизмов, включая грибы, дрожжи и бактерии, до растений и людей.
3.1. Микробные источники амилаз
Несколько бактерий, продуцирующих амилазу, грибов и других микроорганизмов были изолированы и охарактеризованы на протяжении многих десятилетий. Бактерии и грибы выделяют амилазы вне своих клеток для осуществления внеклеточного пищеварения.
Среди видов плесневых грибов, продуцирующих высокие уровни амилазы, представлены Aspergillus niger , Aspergillus oryzae (Aunstrup, 1979), Thermomyces lanuginosus (Arnesen et al., 1998) и Penicillium expansum (Doyle et al., 1989) в дополнение ко многим видам рода Mucor (Domsch et al., 1995; Petruccioli & Federici, 1992; Zare-Maivan & Shearer, 1988). Сообщалось, что четыре вида грибов Ganoderma могут продуцировать относительно слабую амилазу в опилочной среде (Y.W. Wang & Y. Wang, 1990). Амилолитические дрожжи сильно различаются по секреции амилазы и степени гидролиза крахмала (De Mot et al., 1984a, 1984b). Штаммы Filobasidiuim capsuligenum способны к обширному гидролизу крахмала (De Mot et al., 1984c; Макканн и Барнетт, 1984).
Что касается бактерий, Bacillus spp и родственные им роды продуцируют большое количество внеклеточных ферментов, из которых амилазы имеют особое значение для промышленности, например, B. cereus (Rhodes et al., 1987), B. Cycleans (Siggens, 1987), B. subtilis (El-Banna et al., 2007), B. licheniformis (El-Banna et al., 2008) и Clostridium thermosulfurogenes (Hyun & Зейкус, 1985а).Бактерии, принадлежащие в основном к роду Bacillus , широко используются для промышленного производства термостабильной α-амилазы (Тонкова, 2006). Однако большинство из разжижающих амилаз Bacillus , таких как ферменты из B. amyloliquefaciens и B. stearothermophilus , имеют оптимумы pH от 5 до 7,5 (Yamamoto, 1988). Многие щелочные амилазы были обнаружены в культурах Bacillus sp. (Hayashi et al., 1988; Kim et al., 1995). Все эти щелочные амилазы относятся к осахаривающему типу, за исключением ферментов из Bacillus sp. штамм 707 (Kimura et al., 1988) и B. licheniformis TCRDC-B13 (P. Bajpai и P.K. Bajpai, 1989). Термостабильные β-амилазы были выделены из видов Bacillus (Shinke et al., 1974; Takasaki, 1976). Кроме того, штамм A6 Lactobacillus plantarum был выбран благодаря его способности синтезировать большие количества внеклеточной α-амилазы (Giraud et al., 1991). Кроме того, различные рубцовые бактерии проявляют способность использовать крахмал в качестве субстрата для роста и присутствуют в рубце в достаточном количестве, чтобы иметь количественное значение при ферментации этого субстрата. Эти виды включают Bacteroides ruminicola , Ruminobacter amylophilus , Butyrivibrio fibrisolvens , Selenomonas ruminantium и Streptococcus bovis (Russell, 1984).
Гены, кодирующие внутриклеточные α-амилазы, описаны для Escherichia coli и Streptococcus bovis (Satoh et al., 1997; Уайтхед и Котта, 1995). Хотя была проведена некоторая характеристика этих активностей, не было установлено четкой физиологической роли внутриклеточной α-амилазы ни для E. coli , ни для Streptococcus bovis . Однако предполагается, что он играет важную роль в быстром росте клеток в Streptococcus bovis (Brooker & McCarthy, 1997).
Многие гипертермофильные микроорганизмы содержат в своих геномах ферменты, гидролизующие крахмал, даже несмотря на то, что они живут в среде, где крахмал встречается редко (Sambrook et al., 1989). Среди описанных до сих пор ферментов Thermotoga maritime , расщепляющих полисахариды, есть две α-амилазы, одна представляет собой предполагаемый внеклеточный липопротеин (AmyA) (Liebl et al., 1997), а другой находится в цитоплазме (AmyB) (Lim et al. др., 2003). Geobacillus thermoleovorans , как было обнаружено, продуцирует гипертермостабильную, сильно мальтозообразующую и Са 2+ независимую α-амилазу (Malhotra et al. 2000; Narang & Satyanarayana 2001). Сообщалось, что многочисленные гипертермофильные археи, особенно глубоководные виды Thermococcale и Sulfolobus , продуцируют α-амилазы (Leuschner and Antranikian, 1995; Sunna et al., 1997).
Промышленный потенциал высокомальтозообразующих α-амилаз из Thermomonospora curvata (Collins et al., 1993) ограничен их умеренной термостабильностью и требованием Ca 2+ .
α-Амилазы секретируются несколькими видами Streptomyces , например S. albus (Andrews & Ward, 1987), S. griseus IMRU3570 (Vigal et al., 1991), S. thermocyaneoviolaceus (Hang et al., 1996).Ген, кодирующий внеклеточную α-амилазу, был клонирован из многих видов Streptomyces (Bahri & Ward, 1990; Virolle et al., 1988). Кроме того, активность α-амилазы видов Thermoactinomyces впервые была описана Куо и Хартманом (1966). После этого в других исследованиях было обнаружено несколько α-амилаз с разными характеристиками (Obi & Odibo, 1984; Omar et al., 2011; Shimizu et al., 1978; Uguru et al., 1997). Имеющиеся сведения о продукции β-амилазы среди актиномицетов скудны и относятся в основном к нетермостабильному ферменту (Shinke et al., 1974).
3.2. Типы амилаз
Ферменты, относящиеся к амилазам, эндоамилазам и экзоамилазам, способны гидролизовать крахмал. Эти ферменты классифицируются в зависимости от того, как атакуется гликозидная связь. Ферменты, расщепляющие крахмал, обнаруживаются в многочисленных семействах гликозилгидролаз (GH) (13, 14 и 15), главным образом в семействе 13 GH (Coutinho & Henrissat, 1999; Henrissat, 1991).
Эндоамилазы способны расщеплять α, 1-4 гликозидные связи, присутствующие во внутренней части (эндо-) цепи амилозы или амилопектина.α-амилаза (EC 3.2.1.1) - хорошо известная эндоамилаза. Он обнаружен в большом количестве микроорганизмов, принадлежащих как архее, так и бактериям (Pandey et al., 2000). Конечными продуктами действия α-амилазы являются олигосахариды различной длины с α-конфигурацией и α-предельные декстрины, которые представляют собой разветвленные олигосахариды. α-амилазы часто делятся на две категории в зависимости от степени гидролиза субстрата (Fukumoto & Okada, 1963). Осахаривающие α-амилазы гидролизуют от 50 до 60%, а разжижающие α-амилазы расщепляют от 30 до 40% гликозидных связей крахмала.
Ферменты, принадлежащие ко второй группе, экзоамилазы, либо расщепляют исключительно α, 1-4 гликозидные связи, такие как β-амилаза (EC 3.2.1.2), либо расщепляют как α, 1-4, так и α, 1-6 гликозидные связи, такие как амилоглюкозидаза или глюкоамилаза (EC 3.2.1.3) и α-глюкозидаза (EC 3.2.1.20). Экзоамилазы действуют на внешние остатки глюкозы амилозы или амилопектина и, таким образом, продуцируют только глюкозу (глюкоамилазу и α-глюкозидазу) или мальтозу и β-предельный декстрин. β-амилаза и глюкоамилаза также преобразуют аномерную конфигурацию высвобожденной мальтозы из α в β.Глюкоамилаза и α-глюкозидаза различаются по предпочтению субстрата: α-глюкозидаза лучше всего действует на короткие мальтоолигосахариды и высвобождает глюкозу α-конфигурации, тогда как глюкоамилаза лучше всего гидролизует длинноцепочечные полисахариды. β-амилазы и глюкоамилазы также были обнаружены в большом количестве микроорганизмов (Pandey et al., 2000).
3.3. Действие и структура α-амилаз
3.3.1. Механизм действия
В целом считается, что α-амилазы представляют собой эндо-действующие амилазы, которые внутренне гидролизуют α- (1-4) гликозидные связи полимеров крахмала.Было предложено несколько моделей паттерна действия амилазы, таких как случайное действие и действие множественной атаки. Случайное действие также называют однократным или многоцепочечным атакующим действием (Azhari & Lotan, 1991). В первом случае молекула полимера последовательно полностью гидролизуется перед диссоциацией комплекса фермент-субстрат. В то время как в последнем случае за эффективное столкновение гидролизуется только одна связь. Действие множественной атаки является промежуточным между одноцепочечным и многоцепочечным действием (Bijttebier et al., 2008), где фермент последовательно расщепляет несколько гликозидных связей после первой (случайной) гидролитической атаки перед диссоциацией от субстрата.
Короче говоря, можно ясно видеть, что действие множественной атаки является общепринятой концепцией для объяснения различий в паттерне действия амилаз (Kramhøft et al. 2005; Svensson et al. 2002). Однако большинство эндоамилаз имеют низкий или очень низкий уровень множественного атакующего действия (Bijttebier et al., 2008). Хотя лишь несколько сообщений касаются влияния pH и температуры на характер действия амилаз, это влияние было подтверждено.Bijttebier et al. (2007) показали, что уровень множественной атаки нескольких эндоамилаз повышается с повышением температуры до степени, зависящей от самой амилазы.
3.3.2. Молекулярная масса
Несмотря на большое различие характеристик микробных α-амилаз, их молекулярные массы обычно находятся в одном диапазоне 40-70 кДа (Gupta et al., 2003). Ratanakhanokchai et al. (1992) сообщили о самой высокой молекулярной массе α-амилаз, 210 кДа, для Chloroflexus aurantiacus . Принимая во внимание, что 10 кДа α-амилазы Bacillus caldolyticus , как сообщалось, было самым низким значением (Gupta et al., 2003).
Эта молекулярная масса может быть увеличена за счет гликозилирования, как в случае α-амилазы T. vulgaris , которая достигает 140 кДа (Omar et al., 2011). Напротив, протеолиз может привести к снижению молекулярной массы. Например, α-амилаза T. vulganis 94-2A (AmyTV1) представляет собой белок 53 кДа и меньшие пептиды 33 и 18 кДа, которые, как было показано, являются продуктами ограниченного протеолиза AmyTV1 (Hofemeister et al., 1994 ).
3.3.3. Модульная структура
α-амилазы из разных организмов имеют примерно 30% идентичности аминокислотных последовательностей и все принадлежат к одному и тому же семейству 13 гликозилгидролаз (Henrissat & Bairoch, 1993).Трехмерные (3D) структуры α-амилаз выявили мономерные кальцийсодержащие ферменты с единственной полипептидной цепью, свернутой в три домена (A-C).
Самый консервативный домен в ферментах семейства α-амилаз, A-домен, состоит из высокосимметричной складки из восьми параллельных β-цепей, расположенных в цилиндре, окруженном восемью α-спиралями. Высококонсервативные аминокислотные остатки семейства α-амилаз, участвующие в катализе и связывании субстрата, расположены в петлях на С-концах β-цепей в этом домене.Это типично для всех ферментов, принадлежащих к семейству α / β-стволовых белков (Farber & Petsko, 1990).
α-амилазы имеют B-домен, который выступает между β-листом № 3 и α-спиралью № 3. 3. Он составляет от 44 до 133 аминокислотных остатков и играет роль в связывании субстрата или Ca 2+ (Marc et al., 2002). Последовательность этого домена сильно различается; у α-амилазы Bacillus он относительно длинный и складывается в более сложную структуру β-цепей (Machius et al., 1995), тогда как в α-амилазе ячменя присутствует нерегулярно структурированный домен из 64 остатков (Kadziola et al. ., 1994).
Все известные α-амилазы, за некоторыми исключениями, содержат консервативный сайт связывания Ca 2+ , который расположен на границе раздела между доменами A и B (Linden et al., 2003; Prakash & Jaiswal, 2010). Кроме того, было обнаружено, что α-амилаза, продуцируемая Bacillus thermooleovorans , содержит сайт связывания хлорид-иона в их активном центре (Malhotra et al., 2000), который, как было показано, увеличивает каталитическую эффективность фермента, предположительно за счет повышения pKa остатка, дающего водород, в активном центре (Prakash & Jaiswal, 2010).
α-амилазы имеют относительно консервативный домен C, который сворачивается в антипараллельный β-бочонок. Ориентация домена C относительно домена A варьируется в зависимости от типа и источника амилазы (Bayer et al., 1995). Функция этого домена неизвестна.
Структурные исследования подтвердили, что активные центры гликозилгидролаз состоят из множества сайтов связывания или субсайтов для сахарных единиц полимерных субстратов. Открытая щель активного сайта образуется между доменами A и B, так что остатки из домена B участвуют в связывании субстрата.Сайты связывания субстрата обычно выстланы ароматическими остатками, которые осуществляют гидрофобные взаимодействия с кольцами сахара. Кроме того, активные центры содержат много остатков, которые образуют водородные связи с субстратом либо напрямую, либо через молекулы воды (Aleshin et al., 1994; Svensson & Sogaard, 1993).
В Така-амилазе А, первой протеин-α-амилазе, исследованной с помощью рентгеновской кристаллографии, в центре активного центра были обнаружены три кислотных остатка, то есть одна глутаминовая и две аспарагиновые кислоты (Matsuura et al., 1984), и последующие мутационные исследования показали, что эти остатки важны для катализа (Janecek, 1997; Svensson, 1994). В настоящее время считается, что остаток глутаминовой кислоты является донором протона, в то время как первая из двух консервативных аспарагиновых кислот, появляющихся в аминокислотной последовательности члена семейства α-амилаз, как полагают, действует как нуклеофил. Роль второй аспарагиновой кислоты менее определена, но было высказано предположение, что она участвует в стабилизации оксокарбениевого ионоподобного переходного состояния, а также в поддержании глутаминовой кислоты в правильном состоянии протонирования для активности (Uitdehaag et al., 1999). Эти остатки находятся около концов 3, 4, 5 и 7 цепей α / β -бочки и обнаруживаются в четырех коротких последовательностях, давно признанных консервативными в ферментах семейства α-амилазы.
3.3.4. Гликозилирование
Гликозилирование является одной из основных посттрансляционных модификаций, которые влияют на множество функций ферментов, включая секрецию, стабильность и фолдинг (Barros et al., 2009; Shental-Bechor & Levy, 2009). Олигосахариды обычно связаны с боковыми цепями аспарагина (N-связанное гликозилирование) или с боковыми гидроксильными цепями серина и треонина (O-связанное гликозилирование) (Shental-Bechor & Levy, 2009).
Гликопротеины были обнаружены в α-амилазах штаммов A. oryzae (Eriksen et al., 1998), B. stearothermophilus (Srivastava, 1984) и B. subtilis (Matsuzaki et al., 1974; Ямане и др., 1973). Как правило, для большинства α-амилаз это около 10% (Vihinen & Mantsala, 1989). Полагают, что эти углеводные фрагменты ответственны за высокую молекулярную массу некоторых α-амилаз. Сообщается, что содержание углеводов достигает 56% в S.castelii (Sills et al., 1984). Кроме того, высокомолекулярная α-амилаза 140 кДа, продуцируемая T. vulgaris (Abou Dobara et al., 2011), является хорошим примером высоко гликозилированной α-амилазы (Omar et al., 2011). Используя SDS-PAGE, гликопротеины могут быть обнаружены путем начального окисления углеводов периодической кислотой и последующего окрашивания катионными красителями, такими как альциановый синий (Wardi & Michos, 1972).
3.4. Производство микробных α-амилаз
Основным преимуществом использования микроорганизмов для производства амилаз является экономичность массового производства и простота манипуляции с микробами для получения ферментов с желаемыми характеристиками (Lonsane & Ramesh, 1990).Скрининг продуцентов α-амилазы является ключевым этапом производства. Гидролиз крахмала обычно определяется непосредственно на чашках в виде прозрачных зон, окружающих колонии. Диаметр области гидролиза, в определенных пределах, всегда был связан с эффективностью амилазы (Dhawale et al., 1982).
3.4.1. Факторы, влияющие на продукцию
На продукцию и стабильность α-амилазы в среде влияет множество физико-химических факторов. Несмотря на возможность экспрессии в широком диапазоне условий культивирования, α-амилаза может денатурироваться при некоторых условиях.Многие белки легко агрегируют в так называемые тельца включения во время экспрессии в бактериальных системах (Espargaro et al., 2008). Ингибирование агрегации белков во время ферментации / экспрессии может быть достигнуто путем регулирования условий производства (Bahrami et al., 2009; Hao et al., 2007).
Что касается инкубационного периода, многие исследователи обнаружили, что продукция внеклеточной α-амилазы связана с ростом (Abou Dobara et al., 2011; Asoodeh et al., 2010; Murthy et al., 2009).Изменения в продуктивности внеклеточных ферментов можно объяснить различиями во времени индукции отдельных компонентов ферментной системы, ингибированием продуктами гидролиза субстрата и дифференциальной инактивацией протеазами и / или изменением pH в условиях культивирования (Tuohy & Coughlan, 1992; JP Wang et al., 1993). Доказано, что накопление сахаров в среде выше критической концентрации ингибирует выработку ферментов (Dona et al., 2010; J.P. Wang et al., 2006).
Среди физических параметров, температура и pH среды играют важную роль в производстве и стабильности α-амилазы. Как правило, влияние температуры на продукцию амилазы связано с ростом организма. Следовательно, оптимальная температура зависит от того, является ли культура мезофильной, термофильной или психрофильной. Среди грибов и актиномицетов в большинстве исследований продукции амилазы была достигнута оптимальная урожайность в диапазоне 25-40 ° C (Gupta et al., 2003). Однако термофильные грибы, такие как Thermomyces lanuginosus (Mishra & Maheshwari, 1996), и актиномицеты, а именно; Сообщалось, что Thermomonospora fusca (Busch & Stutzenberger, 1997) и Thermoactinomyces vulgaris (Abou Dobara et al., 2011) оптимально продуцируют α-амилазу при 50 ° C, 55 ° C и 55 ° C соответственно. С другой стороны, он был произведен при более широком диапазоне оптимальных температур бактериями, достигающими 90 ° C у видов Thermococcale и Sulfolobus (Leuschner & Antranikian, 1995; Sunna et al., 1997). Также сообщалось, что значения pH служат индикатором начала и окончания синтеза ферментов (Friedrich et al., 1989), поскольку изменение pH влияет на стабильность α-амилазы в среде (Calamai et al., 2005). Стоит отметить, что активный центр α-амилазы состоит из большого количества заряженных групп (Lawson et al., 1994; Strokopytov et al., 1996; Uitdehaag et al., 1999), что объясняет тот факт, что большинство α-амилаз имели оптимальный pH в диапазоне от кислого до нейтрального (Bozic et al., 2011; Pandey et al., 2000; Sun et al., 2010).
Обычно активность амилазы связана с утилизацией субстрата. Природа индуцибельности α-амилазы подтверждена у различных микроорганизмов (Abou Dobara et al., 2011; Aiyer, 2004; Asoodeh et al., 2010; Ryan et al., 2006). Производство α-амилазы также, как оказалось, подвергается катаболической репрессии мальтозой и глюкозой, как и большинство других индуцибельных ферментов, на которые влияют продукты гидролиза субстрата (Bhella & Altosaar, 1988; Morkeberg et al., 1995). Однако, как сообщалось, синтез α-амилазы штаммами Bacillus не подвергался катаболической репрессии моносахаридами (Kalishwaralal et al., 2010). Gupta et al. (2003) классифицировали ксилозу и фруктозу как сильно подавляющие синтез α-амилазы. Добавление крахмала к среде обычно используют для получения α-амилазы из различных микроорганизмов, как сообщается в литературе.
Источник азота как базовый компонент среды является основным фактором, влияющим на продукцию α-амилазы.Его эффект был не только как источник азота, но также как источник ионов металлов и регулятор pH. Многие исследователи зафиксировали, что источники органического азота поддерживают максимальное производство α-амилазы различными бактериями (Abou Dobara et al., 2011; Aqeel & Umar, 2010; Mrudula & Kokila, 2010; Saxena et al., 2007). Повышенное производство α-амилазы органическими источниками азота можно объяснить высоким содержанием пищевых аминокислот и витаминов. Однако сообщалось, что различные неорганические соли способствуют лучшему продуцированию грибами (Gupta et al., 2003). Было обнаружено, что как источник ионов металла хлорид аммония усиливает продукцию α-амилазы T. vulgaris , где хлорид является стабилизатором, по сравнению с другими солями аммония (Abou Dobara et al., 2011). Кроме того, те же авторы сообщили о разной продуктивности α-амилазы при использовании нитрата натрия из нитрата калия.
3.4.2. Измерение активности фермента
Разнообразие и гетерогенность природных субстратов в сочетании со смешанной специфичностью отдельных ферментов представляет проблему при характеристике амилаз.Кроме того, ферментативная деградация природных нерастворимых субстратов включает стадии и механизмы, которые еще не поняты на молекулярном уровне. Поэтому в биохимических исследованиях всегда используют крахмал в некоторой модифицированной форме для упрощения анализа. Существует четыре основных типа субстратов, используемых для измерения активности: очищенные нерастворимые субстраты, приближенные к природному субстрату, модифицированные нерастворимые субстраты, растворимые модифицированные полисахариды и растворимые олигосахариды. Каталитическую активность обычно измеряют путем количественного определения образовавшихся растворимых сахаридов или хромофорного агликона.Действие фермента на нерастворимые субстраты также можно оценить другими способами. Например, вискозиметрический метод был использован для измерения активности α-амилазы на крахмальных пастах (Marciniak & Kula, 1982).
Измерение растворимых продуктов из нерастворимых или растворимых полимерных субстратов часто означает анализ образовавшихся восстанавливающих сахаров. Одним из самых простых и наиболее широко используемых является метод 3,5-динитросалициловой кислоты (DNS) (Miller, 1959). Однако развитие окраски в реакции не строго пропорционально количеству присутствующих редуцирующих сахаров, но также и длине олигосахаридов, что приводит к более высоким кажущимся восстанавливающим значениям с более длинными сахарами (Robyt & Whelan, 1972).Сам DNS также ломает основу. Также было разработано несколько других методов определения редуцирующего сахара. В некоторых случаях к полимерному субстрату были прикреплены группы красителей, например окрашенный амилозой и амилопектин (Klein et al., 1970) и окрашенный и поперечно-сшитый крахмал (Cesk et al., 1969). Ферментативный анализ основан на окрашивании субстрата.
Крахмал образует с йодом комплекс темно-синего цвета, при прогрессирующем гидролизе крахмала он становится красно-коричневым. Было описано несколько процедур количественного определения амилазы, основанных на снижении интенсивности синего цвета в результате ферментативного гидролиза крахмала (Swain et al., 2006). Этот метод определяет декстринизирующую активность α-амилазы с точки зрения снижения цветовой реакции йода. Кроме того, для амилаз используются комбинированные методы анализа, в которых концентрация высвобожденной глюкозы определяется либо глюкозооксидазой / пероксидазой (Kunst et al., 1984), либо методом гексокиназы / глюкозо-6-фосфатдегидрогеназы (Rauscher, 1984). ).
Как правило, различные доступные методы определения активности α-амилазы основаны на уменьшении интенсивности крахмал-йодной окраски, увеличении содержания редуцирующих сахаров, разложении окрашенного в комплекс субстрата и снижении вязкости суспензии крахмала.
3.4.3. Очистка фермента
Очистка - ключевой этап производства ферментов, при котором удаляются остаточные клеточные белки и другие загрязнения. Различные методы были разработаны для очистки ферментов на основе их свойств до их характеристики или использования в биотехнологических и промышленных процессах. Коммерческое использование α-амилазы обычно не требует очистки фермента, но для применения ферментов в пищевой, фармацевтической и клинической отраслях требуются амилазы высокой чистоты.Фермент в очищенной форме также является необходимым условием при изучении взаимосвязей между структурой и функцией и биохимических свойств.
Используемые методы очистки амилаз могут значительно различаться, но большинство протоколов очистки включают серию шагов (Sun et al., 2010). Выбор протокола очистки, естественно, зависит от предполагаемого использования, причем наивысшая чистота обычно требуется для основных целей, в которых даже разделение изоферментов может быть важным. Чистота и достигаемый выход зависят от количества стадий и используемых методов разделения.
Для очистки α-амилаз от микробных источников в большинстве случаев использовались классические методы очистки. Эти методы включают отделение культуры от ферментационного бульона, селективное концентрирование путем осаждения с использованием сульфата аммония или органических растворителей. Затем неочищенный фермент подвергают хроматографии. Наиболее часто используемые методы - это аффинная хроматография, ионный обмен и / или гель-фильтрация. Сшитый крахмал или производные крахмала являются полезными аффинными адсорбентами для выделения бактериальных α-амилаз (Somers et al., 1995). Primarini & Ohta (2000) выделили и разделили две чистые α-амилазы из Streptomyces sp. с использованием адсорбции крахмала, α-CD Sepharose 6B и DEAE-Toyopearl 650M. Адсорбция α-амилазы из Streptomyces sp. E-2248; на крахмале с последующим разделением на DEAE-Toyopearl и Toyopearl-HW55S дает самую высокую степень очистки (2130-кратную) (Kaneko et al., 2005). Кроме того, α-амилаза из Bacillus licheniformis была очищена в 6 раз с выходом 38% с использованием двух стадий гель-фильтрационной хроматографии на колонке Sephadex G-100 и Superose 12 (Bozic et al., 2011).
В дополнение к классическим хроматографическим методам иммуноаффинная хроматография применялась для получения высокоочищенных амилаз (Jang et al., 1994). Недавние успехи в понимании физических и функциональных свойств амилаз, а также селективности и емкости адсорбентов привели к большей рациональности в разработке методов разделения. Однако возможности методов разделения амилаз не были полностью использованы.
3.4.4. Промышленные желательные аспекты
Стабильность биокатализаторов часто является ограничивающим фактором при выборе ферментов для промышленного применения из-за повышенной температуры или экстремального pH во многих биотехнологических процессах. Следовательно, существует постоянная потребность в улучшении стабильности ферментов и, следовательно, в удовлетворении требований, установленных для конкретных приложений.
Например, проблема традиционных моющих ферментов состоит в том, что они должны работать в стиральной машине в условиях, которые очень неблагоприятны для стабильности фермента.В условиях стирки pH очень щелочной. Высокая температура (55–60 ° C) в посудомоечной машине требует наличия термостабильных ферментов. Кроме того, предпочтительно быть устойчивым к различным ингредиентам моющих средств, таким как поверхностно-активные вещества, хелатирующие и окислительные агенты (отбеливатели).
В целом, температура оказывает комплексное влияние на белок, прямо или косвенно, как на физические, так и на химические процессы агрегации (Y.W. Wang et al., 2010). Следовательно, это наиболее важный фактор окружающей среды, который следует учитывать при работе с белками в течение всего процесса разработки и коммерциализации.Преимущества использования термостабильных α-амилаз в промышленных процессах включают снижение риска загрязнения, повышенную скорость диффузии и снижение стоимости внешнего охлаждения. Короче говоря, почти во всех отраслях промышленности требуются термостабильные ферменты. Помимо термостабильности и других факторов, таких как активность с высокими концентрациями крахмала, то есть более 30% сухих веществ, или выход белка при промышленной ферментации, являются важными критериями для коммерциализации (Schäfer et al., 2000). Также желательно, чтобы α-амилазы с широким диапазоном pH удовлетворяли всем требованиям, будь то кислые, как производство глюкозного сиропа, или щелочи, как моющие средства.
Однако в последнее время наблюдается тенденция к использованию α-амилазы со средней температурной стабильностью (ITS) (Ahuja et al., 1998, цитируется у Gupta et al., 2003). Олесен (1991) обнаружил, что эта особенность делает фермент полезным для хлебопекарной промышленности, так как предотвращает липкость хлеба. Кроме того, современной тенденцией среди потребителей является использование более низких температур для стирки или мытья посуды. При таких более низких температурах моющие средства с α-амилазами, оптимально работающие при умеренных температурах и щелочном pH, будут подходящими (Marc et al., 2002). Хотя известно большое количество микробных α-амилаз, α-амилаза со свойством «ITS» была обнаружена лишь у нескольких микроорганизмов (Gigras et al., 2002).
Еще одна важная желательная характеристика - кальциевая независимость. Большинство известных α-амилаз, за некоторыми исключениями, содержат консервативный сайт связывания Ca 2+ (Linden et al., 2003; Prakash & Jaiswal, 2010), что делает кальций важным для активности фермента. При производстве фруктозного сиропа ионы Ca 2+ ингибируют фермент глюкозоизомеразу, используемый на последней стадии процесса (Тонкова, 2006), и могут приводить к образованию неорганических осадков, которые оказывают вредное воздействие на ферментацию и последующую переработку ( Kelly et al., 2009). Поскольку удаление этих ионов металлов требует затрат и времени для всего производственного процесса (Kelly et al., 2009), использование стабильных и функциональных α-амилаз в отсутствие ионов Ca 2+ при высоких температурах может пользоваться большим уважением.
.Следует ли использовать йодированную соль?
Есть большая вероятность, что вы заметите коробку с йодированной солью в любой кухонной кладовой.
Несмотря на то, что это основной продукт питания во многих семьях, существует большая путаница в отношении того, что такое йодированная соль на самом деле и является ли она необходимой частью рациона.
В этой статье рассматривается, как йодированная соль может повлиять на ваше здоровье и следует ли вам ее использовать.
Йод - это микроэлемент, который обычно содержится в морепродуктах, молочных продуктах, зернах и яйцах.
Во многих странах его также добавляют в сочетании с поваренной солью, чтобы предотвратить дефицит йода.
Ваша щитовидная железа использует йод для выработки гормонов щитовидной железы, которые помогают в восстановлении тканей, регулируют обмен веществ и способствуют правильному росту и развитию (1, 2).
Гормоны щитовидной железы также играют непосредственную роль в контроле температуры тела, артериального давления и частоты сердечных сокращений (3).
Помимо своей важной роли в здоровье щитовидной железы, йод может играть центральную роль в некоторых других аспектах вашего здоровья.
Например, исследования в пробирках и на животных показывают, что это может напрямую влиять на функцию вашей иммунной системы (4, 5).
Между тем, другие исследования показали, что йод может помочь в лечении фиброзно-кистозной болезни груди, состояния, при котором в груди формируются доброкачественные образования (6, 7).
РезюмеВаша щитовидная железа использует йод для выработки гормонов щитовидной железы, которые играют роль в восстановлении тканей, метаболизме, росте и развитии. Йод также может повлиять на здоровье иммунной системы и помочь в лечении фиброзно-кистозной болезни груди.
К сожалению, многие люди во всем мире подвержены повышенному риску йодной недостаточности.
Это считается проблемой общественного здравоохранения в 118 странах, и более 1,5 миллиарда человек считаются подверженными риску (8).
Дефицит питательных микроэлементов, таких как йод, становится все более распространенным в определенных областях, особенно в регионах, где йодированная соль встречается редко или в почве низкий уровень йода.
Фактически, по оценкам, около трети населения Ближнего Востока подвержено риску дефицита йода (9).
Это состояние также часто встречается в таких регионах, как Африка, Азия, Латинская Америка и некоторые части Европы (8).
Кроме того, определенные группы людей чаще страдают дефицитом йода. Например, беременные или кормящие женщины подвергаются более высокому риску дефицита, поскольку им требуется больше йода.
Веганы и вегетарианцы также подвержены большему риску. В одном исследовании изучалась диета 81 взрослого человека, и было обнаружено, что 25% вегетарианцев и 80% веганов имели дефицит йода по сравнению с 9% тех, кто придерживался смешанной диеты (10).
РезюмеДефицит йода - серьезная проблема во всем мире. Женщины, которые беременны или кормят грудью, придерживаются веганской или вегетарианской диеты и живут в определенных регионах мира, подвергаются большему риску дефицита.
Дефицит йода может вызвать длинный список симптомов, варьирующихся от легкого дискомфорта до серьезного и даже опасного.
Среди наиболее частых симптомов - отек шеи, известный как зоб.
Ваша щитовидная железа использует йод для производства гормонов щитовидной железы. Однако, когда вашему организму его не хватает, ваша щитовидная железа вынуждена работать с перегрузкой, чтобы попытаться компенсировать это и произвести больше гормонов.
Это вызывает быстрое размножение и рост клеток щитовидной железы, что приводит к зобу (11).
Снижение гормонов щитовидной железы может также привести к другим побочным эффектам, таким как выпадение волос, усталость, увеличение веса, сухость кожи и повышенная чувствительность к холоду (12).
Дефицит йода может вызывать серьезные проблемы также у детей и беременных женщин. Низкий уровень йода может вызвать повреждение мозга и серьезные проблемы с умственным развитием у детей (8).
Более того, это также может быть связано с более высоким риском выкидыша и мертворождения (13).
РезюмеДефицит йода может нарушить выработку гормонов щитовидной железы, что приводит к таким симптомам, как отек шеи, усталость и увеличение веса. Это также может вызвать проблемы у детей и беременных женщин.
В 1917 году врач Дэвид Марин начал проводить эксперименты, демонстрирующие, что прием добавок йода эффективно снижает частоту возникновения зоба.
Вскоре после того, как в 1920 году, многие страны по всему миру начали обогащать поваренную соль йодом, чтобы предотвратить дефицит йода.
Введение йодированной соли было невероятно эффективным в устранении дефицита во многих частях мира. До 1920-х годов до 70% детей в некоторых районах США болели зобом.
Напротив, сегодня 90% населения США имеет доступ к йодированной соли, и население считается в целом достаточным для йода (14).
Всего пол чайной ложки (3 грамма) йодированной соли в день достаточно для удовлетворения суточной потребности в йоде (15).
Это делает использование йодированной соли одним из самых простых способов предотвратить йододефицит без необходимости вносить другие серьезные изменения в свой рацион.
РезюмеВ 1920-х годах органы здравоохранения начали добавлять йод в поваренную соль, чтобы предотвратить дефицит йода.Всего пол чайной ложки (3 грамма) йодированной соли может удовлетворить ваши ежедневные потребности в этом минерале.
Исследования показывают, что потребление йода сверх рекомендуемой дневной нормы обычно хорошо переносится.
Фактически, верхний предел йода составляет 1100 микрограммов, что эквивалентно 6 чайным ложкам (24 граммам) йодированной соли, если каждая чайная ложка содержит 4 грамма соли (15).
Однако чрезмерное потребление соли, йодированной или нет, не рекомендуется. Всемирная организация здравоохранения (ВОЗ) рекомендует взрослым употреблять менее 5 граммов соли в день (16).
Следовательно, вы превысите безопасный уровень потребления соли задолго до того, как превысите рекомендуемую дневную дозу йода.
Высокое потребление йода может увеличить риск дисфункции щитовидной железы у определенных групп людей, включая плоды, новорожденных, пожилых людей и людей с уже существующим заболеванием щитовидной железы.
Избыточное потребление йода может быть результатом диетических источников, йодсодержащих витаминов и лекарств, а также приема йодных добавок (17).
Тем не менее, многочисленные исследования показали, что йодированная соль безопасна с минимальным риском побочных эффектов для населения в целом, даже в дозах, почти в семь раз превышающих рекомендованные суточные значения (18, 19, 20).
РезюмеИсследования показывают, что йодированная соль безопасна для употребления с минимальным риском побочных эффектов. Безопасный верхний предел йода составляет почти 4 чайные ложки (23 грамма) йодированной соли в день. Некоторым группам населения следует избегать потребления.
Хотя йодированная соль - удобный и простой способ увеличить потребление йода, это не единственный его источник.
Фактически, вполне возможно удовлетворить ваши потребности в йоде, не употребляя йодированную соль.
Другие хорошие источники включают морепродукты, молочные продукты, зерно и яйца.
Вот несколько примеров продуктов, богатых йодом:
- Морские водоросли: 1 сушеный лист содержит 11–1989% от RDI
- Треска: 3 унции (85 граммов) содержат 66% RDI
- Йогурт: 1 чашка (245 граммов) содержит 50% RDI
- Молоко: 1 чашка (237 мл) содержит 37% RDI
- Креветки: 3 унции (85 граммов) содержат 23% от РСНП
- Макароны: 1 чашка (200 граммов) вареных содержит 18% от РСНП
- Яйцо: 1 большое яйцо содержит 16% от РСНП
- Консервированный тунец: 3 унции (85 граммов) содержит 11% от РСНП
- Сушеный чернослив: 5 черносливов содержат 9% от РСНП
Взрослым рекомендуется получать не менее 150 микрограммов йода в день.Для беременных или кормящих женщин это количество возрастает до 220 и 290 мкг в день соответственно (15).
Потребляя всего несколько порций богатой йодом пищи каждый день, вы можете легко получить достаточное количество йода из своего рациона, с использованием йодированной соли или без нее.
РезюмеЙод также содержится в морепродуктах, молочных продуктах, зернах и яйцах. Употребление нескольких порций продуктов, богатых йодом, в день может помочь вам удовлетворить ваши потребности, даже без йодированной соли.
Если вы придерживаетесь сбалансированной диеты, которая включает другие источники йода, такие как морепродукты или молочные продукты, вы, вероятно, получаете достаточное количество йода в своем рационе только из пищевых источников.
Однако, если вы считаете, что подвержены более высокому риску йодной недостаточности, вы можете рассмотреть возможность использования йодированной соли.
Кроме того, если вы не получаете хотя бы несколько порций богатой йодом пищи каждый день, йодированная соль может быть простым решением, чтобы убедиться, что вы удовлетворяете свои повседневные потребности.
Рассмотрите возможность использования его в сочетании с разнообразной питательной диетой, чтобы обеспечить удовлетворение своих потребностей в йоде и других важных питательных веществах.
.