До каких продуктов окисляются альдегиды
Химические свойства альдегидов и кетонов
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
| Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода. |
Структурная формула альдегидов:
| Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами. |
Структурная формула кетонов:
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении альдегиды превращаются в карбоновые кислоты. Альдегид → карбоновая кислота |
| Метаналь окисляется сначала в муравьиную кислоту, затем в углекислый газ: Формальдегид→ муравьиная кислота→ углекислый газ |
| Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны |
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
| Например, муравьиный альдегид окисляется гидроксидом меди (II) |
HCHO + Cu(OH)2 = Cu + HCOOH + H2O
Чаще в этой реакции образуется оксид меди (I):
HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
| Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония |
| Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония |
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
| Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота |
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
| Например, уравнение сгорания метаналя: |
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
| Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя |
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
| ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ На этой странице рассматриваются способы различения альдегидов и кетонов с использованием окислителей, таких как подкисленный раствор дихромата калия (VI), реагент Толленса, раствор Фелинга и раствор Бенедикта. Фон Почему альдегиды и кетоны ведут себя по-разному? Вы помните, что разница между альдегидом и кетоном заключается в наличии атома водорода, присоединенного к двойной связи углерод-кислород в альдегиде.Кетоны не содержат водорода.
Присутствие этого атома водорода делает альдегиды очень легко окисляющимися. Или, другими словами, они сильные восстановители. | |||||
| Примечание: Если вы не уверены в окислении и восстановлении, было бы неплохо перейти по этой ссылке в другую часть сайта, прежде чем продолжить. Вы также можете вернуться по этой ссылке, если позже на этой странице вам понадобится помощь. Используйте кнопку BACK (или файл HISTORY или меню GO, если вас серьезно задержали) в вашем браузере, чтобы вернуться на эту страницу. | |||||
| Поскольку кетоны не имеют этого конкретного атома водорода, они устойчивы к окислению. Только очень сильные окислители, такие как раствор манганата калия (VII) (раствор перманганата калия), окисляют кетоны - и они делают это разрушительным образом, разрывая углерод-углеродные связи. Если вы не используете эти мощные окислители, вы легко сможете отличить альдегид от кетона.Альдегиды легко окисляются различными окислителями, а кетоны - нет. Подробную информацию об этих реакциях вы найдете ниже на странице. Что образуется при окислении альдегидов? Это зависит от того, проводится ли реакция в кислой или щелочной среде. В кислых условиях альдегид окисляется до карбоновой кислоты. В щелочных условиях он не может образоваться, потому что он реагирует с щелочью.Вместо этого образуется соль.
| |||||
| Примечание: В случае метаналя, HCHO, окисление идет дальше. Образующиеся метановая кислота или ионы метаноата легко окисляются до диоксида углерода и воды. | |||||
| Построение уравнений для реакций окисления Если вам нужно разработать уравнения для этих реакций, единственный надежный способ их построения - использовать электронные полууравнения. Очевидно, что полууравнение окисления альдегида варьируется в зависимости от того, проводите ли вы реакцию в кислых или щелочных условиях. В кислых условиях это:
. . . и в щелочных условиях:
| |||||
| Примечание: Эти электронные полууравнения довольно легко решить с нуля. Нет никакой реальной необходимости их помнить. Перейдите по этой ссылке, если вы не знаете, как это сделать, или если вы не уверены в использовании этих уравнений.Эти конкретные примеры не рассматриваются, но методика остается неизменной независимо от уравнения. Поскольку я собираюсь довольно часто использовать электронные полууравнения на оставшейся части этой страницы, определенно стоит перейти по этой ссылке, если они вам не нравятся. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||
| Эти полууравнения затем объединяются с полууравнениями для любого используемого окислителя.Примеры подробно приведены ниже. Конкретные примеры В каждом из следующих примеров мы предполагаем, что вы знаете, что у вас есть альдегид или кетон. Есть много других вещей, которые также могут дать положительный результат. | |||||
| Примечание: Перейдите по этой ссылке, чтобы узнать, как проверить двойную связь углерод-кислород в альдегидах и кетонах. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||
| Если вы знаете, что это должно быть одно или другое, в каждом случае кетон ничего не делает. Только альдегид дает положительный результат. Использование подкисленного раствора дихромата калия (VI) Небольшое количество раствора дихромата калия (VI) подкисляют разбавленной серной кислотой и добавляют несколько капель альдегида или кетона. Если на морозе ничего не происходит, смесь несколько минут аккуратно подогревают - например, в стакане с горячей водой.
Оранжевые ионы дихромата (VI) восстановлены альдегидом до зеленых ионов хрома (III). В свою очередь, альдегид окисляется до соответствующей карбоновой кислоты. Электронное полууравнение восстановления ионов дихромата (VI):
Объединяя это с полууравнением окисления альдегида в кислых условиях:
.. . дает общее уравнение:
| |||||
| Примечание: Вы можете задаться вопросом, почему я так потрудился разработать полное уравнение для этой реакции (и последующих) вместо того, чтобы использовать символы вроде [O], которые часто используются в органической химии. Проблема в том, что при использовании этих реакций в качестве тестов важно изменение цвета окислителя. В этой конкретной реакции вы должны объяснить, например, почему раствор становится зеленым.Любое уравнение, которое вы пишете, должно показывать образование ионов хрома (III). Если вы не уверены, как именно объединить два полууравнения, чтобы получить окончательное уравнение, перейдите по последней ссылке (далее вверх по странице), чтобы узнать, как это сделать, а затем вернитесь и попробуйте сами проверить что вы можете получить правильный ответ. | |||||
| С использованием реактива Толленса (тест серебряного зеркала) Реагент Толленса содержит ион диамминесеребра (I), [Ag (NH 3 ) 2 ] + . Изготовлен из раствора нитрата серебра (I). Вы добавляете каплю раствора гидроксида натрия, чтобы получить осадок оксида серебра (I), а затем добавляете ровно столько разбавленного раствора аммиака, чтобы снова растворить осадок. Для проведения теста вы добавляете несколько капель альдегида или кетона в свежеприготовленный реагент и осторожно нагреваетесь на горячей водяной бане в течение нескольких минут.
Альдегиды восстанавливают ион диамминесеребра (I) до металлического серебра. Поскольку раствор является щелочным, сам альдегид окисляется до соли соответствующей карбоновой кислоты. | |||||
| Примечание: Если вы действительно получаете серебряное зеркало, это очень хорошо, но серого осадка достаточно, чтобы показать, что тест прошел. Получите ли вы серебряное зеркало или нет, это вопрос удачи. Я наблюдал, как по-настоящему внимательные ученики тщательно все чистят и очень тщательно следят за количеством, но при этом получают лишь след от зеркала.С другой стороны, студенты, которые только что бросили все вместе в первую попавшуюся грязную пробирку, могут получить чудесное зеркало. Жизнь не всегда справедлива! | |||||
| Электронное полууравнение восстановления ионов диамминсеребра (I) до серебра:
Объединяя это с полууравнением окисления альдегида в щелочных условиях:
. . . дает общее уравнение:
Использование решения Фелинга или решения Бенедикта РешениеФелинга и решение Бенедикта по сути являются вариантами одного и того же.Оба содержат комплексные ионы меди (II) в щелочном растворе. Раствор Фелинга содержит ионы меди (II) в комплексе с тартрат-ионами в растворе гидроксида натрия. Комплексирование ионов меди (II) с ионами винной кислоты предотвращает осаждение гидроксида меди (II). Раствор Бенедикта содержит ионы меди (II) в комплексе с ионами цитрата в растворе карбоната натрия. И снова комплексное образование ионов меди (II) предотвращает образование осадка - на этот раз карбоната меди (II). Оба решения используются одинаково. К реагенту добавляют несколько капель альдегида или кетона, и смесь осторожно нагревают на горячей водяной бане в течение нескольких минут.
Альдегиды восстанавливают комплексный ион меди (II) до оксида меди (I).Поскольку раствор является щелочным, сам альдегид окисляется до соли соответствующей карбоновой кислоты. | |||||
| Примечание: Я наблюдал, как студенты проводят эту реакцию с альдегидами и раствором Фелинга в течение многих лет. Получение темно-красного осадка, описанного во всех книгах, на самом деле было довольно редкостью! Потребовалось много воображения, чтобы выделить красный цвет среди всех других цветов, которые вы также можете получить. Это не было одним из моих любимых тестов.Я никогда не использовал решение Бенедикта - возможно, оно лучше! Метаналь является настолько мощным восстановителем, что ионы меди (II) могут быть восстановлены до металлической меди, которую часто можно увидеть как очень красивое медное зеркало на трубке. | |||||
| Уравнения этих реакций всегда упрощаются, чтобы избежать необходимости записывать формулы для ионов тартрата или цитрата в комплексах меди. Электронные полууравнения как для решения Фелинга, так и для решения Бенедикта можно записать как:
Объединяя это с полууравнением окисления альдегида в щелочных условиях:
.. . дает общее уравнение:
| |||||
| Примечание: Если вы действительно внимательны, вы можете задаться вопросом, откуда берутся ионы гидроксида, если вы говорите о растворе Бенедикта, который подщелачивают с помощью карбоната натрия. Раствор карбоната натрия является щелочным, потому что ионы карбоната обратимо реагируют с водой с образованием ионов гидроксида (и ионов гидрокарбоната). | |||||
© Джим Кларк 2004 (изменено в ноябре 2015 г.) | |||||
Реакции альдегидов и кетонов
Реакции альдегидов и кетонов
Альдегиды и кетоны подвергаются множеству реакций, в результате которых образуется множество различных продуктов. Наиболее распространенными реакциями являются реакции нуклеофильного присоединения, которые приводят к образованию спиртов, алкенов, диолов, циангидринов (RCH (OH) C & tbond; N) и иминов R 2 C & dbond; NR), чтобы упомянуть несколько репрезентативных примеров.
Реакции карбонильных групп
Основные реакции карбонильной группы - это нуклеофильные присоединения к двойной связи углерод-кислород.Как показано ниже, это добавление состоит из добавления нуклеофила и водорода через двойную связь углерод-кислород.
Из-за разницы в электроотрицательности карбонильная группа поляризована. Атом углерода имеет частично положительный заряд, а атом кислорода - частично отрицательный.
Альдегиды обычно более реактивны к нуклеофильным заменам, чем кетоны, из-за как стерических, так и электронных эффектов. В альдегидах относительно небольшой атом водорода присоединен к одной стороне карбонильной группы, в то время как большая группа R присоединена к другой стороне.Однако в кетонах группы R присоединены к обеим сторонам карбонильной группы. Таким образом, у альдегидов стерические затруднения меньше, чем у кетонов.
В электронном виде альдегиды имеют только одну группу R для доставки электронов к частично положительному карбонильному углероду, в то время как кетоны имеют две поставляющие электроны группы, присоединенные к карбонильному углероду. Чем большее количество электронов поступает на карбонильный углерод, тем меньше частичный положительный заряд на этом атоме и тем слабее он становится как ядро.
Добавление воды
Добавление воды к альдегиду приводит к образованию гидрата.
Образование гидрата происходит по механизму нуклеофильного присоединения.
1. Вода, действуя как нуклеофил, притягивается к частично положительному углероду карбонильной группы, образуя ион оксония.
2. Ион оксония высвобождает ион водорода, который захватывается анионом кислорода в кислотно-щелочной реакции.
Эту реакцию катализируют небольшие количества кислот и оснований. Это происходит потому, что добавление кислоты вызывает протонирование кислорода карбонильной группы, что приводит к образованию полного положительного заряда на карбонильном углероде, что делает углерод хорошим ядром. Добавление гидроксильных ионов изменяет нуклеофил с воды (слабый нуклеофил) на гидроксид-ион (сильный нуклеофил). Кетоны обычно не образуют стабильных гидратов.
Добавление спирта
Реакции альдегидов со спиртами дают либо полуацеталей (функциональная группа, состоящая из одной группы -ОН и одной группы -OR, связанных с одним и тем же углеродом), либо ацеталей (функциональная группа, состоящая из двух групп -OR, связанных с одним и тем же атомом углерода). углерод), в зависимости от условий.Смешивание двух реагентов вместе дает полуацеталь. Смешивание двух реагентов с соляной кислотой дает ацеталь. Например, реакция метанола с этаном дает следующие результаты:
При нуклеофильном замещении двойной связи карбонильной группы группой ОН образуется полуацеталь по следующему механизму:
1. Неподеленная электронная пара на атоме кислорода спирта атакует карбонильную группу.
2.Потеря иона водорода анионом кислорода стабилизирует ион оксония, образованный на этапе 1.
Добавление кислоты к полуацеталю приводит к образованию ацеталя по следующему механизму:
1. Протон, образующийся при диссоциации соляной кислоты, протонирует молекулу спирта в кислотно-основной реакции.
2. Неподеленная электронная пара гидроксильного кислорода полуацеталя удаляет протон из протонированного спирта.
3. Ион оксония теряется из полуацеталя в виде молекулы воды.
4. Вторая молекула спирта атакует карбонильный углерод, образующий протонированный ацеталь.
5. Ион оксония отдает протон молекуле спирта, освобождая ацеталь.
Устойчивость ацеталей
Реакции образования ацеталей обратимы в кислых условиях, но не в щелочных.Эта характеристика делает ацеталь идеальной защитной группой для молекул альдегида, которые должны подвергаться дальнейшим реакциям. Защитная группа - это группа, которая вводится в молекулу для предотвращения реакции чувствительной группы, в то время как реакция осуществляется в каком-либо другом месте молекулы. Защитная группа должна иметь способность легко реагировать обратно с исходной группой, из которой она была образована. Примером является защита альдегидной группы в молекуле, так что сложноэфирная группа может быть восстановлена до спирта.
В предыдущей реакции альдегидная группа превращается в ацетальную группу, таким образом предотвращая реакцию на этом участке, когда дальнейшие реакции проходят на остальной части молекулы.
Обратите внимание, что в предыдущей реакции карбонильная группа кетона была восстановлена до спирта в результате реакции с LiAlH 4 . Защищенная альдегидная группа не восстановлена. Гидролиз продукта восстановления восстанавливает исходную альдегидную группу в конечном продукте.
Добавление цианистого водорода
Добавление цианистого водорода к карбонильной группе альдегида или большинства кетонов дает циангидрин. Однако стерически затрудненные кетоны не подвергаются этой реакции.
Механизм добавления цианистого водорода представляет собой прямое нуклеофильное присоединение через карбонильную кислородную связь карбонила.
Добавление илидов (реакция Виттига)
Реакция альдегидов или кетонов с илидами фосфора дает алкены с однозначными двойными связями.Илиды фосфора получают реакцией фосфина с алкилгалогенидом с последующей обработкой основанием. Илиды имеют положительный и отрицательный заряды на соседних атомах.
На следующем рисунке показано получение 2-метилбутена по реакции Виттига.
Добавление металлоорганических реагентов
Реагенты Гриньяра, литийорганические соединения и алкиниды натрия реагируют с формальдегидом с образованием первичных спиртов, всех других альдегидов с образованием вторичных спиртов и кетонов с образованием третичных спиртов.
Добавление производных аммиака
Альдегиды и кетоны реагируют с первичными аминами с образованием класса соединений, называемых иминами.
Механизм образования имина проходит через следующие этапы:
1. Неподеленная пара электронов на азоте амина притягивается к частично положительному углероду карбонильной группы.
2. Протон переносится от азота к аниону кислорода.
3. Гидроксильная группа протонируется с образованием иона оксония, который легко освобождает молекулу воды.
4. Неподеленная пара электронов на азоте мигрирует к положительному кислороду, вызывая потерю молекулы воды.
5. Протон от положительно заряженного азота переносится в воду, что приводит к образованию имина.
Имины альдегидов относительно стабильны, тогда как имины кетонов нестабильны.Производные иминов, которые образуют стабильные соединения с альдегидами и кетонами, включают фенилгидразин, 2,4-динитрофенилгидразин, гидроксиламин и семикарбазид.
Оксимы, 2,4-динитрофенилгидразоны и семикарбазоны часто используются в качественной органической химии как производные альдегидов и кетонов.
Окисление альдегидов и кетонов
Альдегиды могут быть окислены до карбоновой кислоты с помощью как слабых, так и сильных окислителей.Однако кетоны могут быть окислены до различных типов соединений только с использованием очень сильных окислителей. Типичные окислители для альдегидов включают перманганат калия (KMnO 4 ) или дихромат калия (K 2 Cr 2 O 7 ) в растворе кислоты и реагент Толленса. Пероксикислоты, такие как пероксибензойная кислота:
Окисление Байера-Виллигера - это процесс окисления кетонов, для которого требуется чрезвычайно сильный окислитель пероксибензойная кислота.Например, пероксибензойная кислота окисляет фенилметилкетон до фенилацетата (сложного эфира).
Альдольные реакции
Помимо нуклеофильных добавок, альдегиды и кетоны демонстрируют необычную кислотность атомов водорода, присоединенных к альфа-углеродам (смежным) с карбонильной группой. Эти водороды называются α-атомами водорода, а углерод, с которым они связаны, является α-углеродом. В этанале есть один α-углерод и три α-водорода, а в ацетоне - два α-углерода и шесть α-атомов водорода.
Хотя и слабокислый (K a 10 −19 до 10 −20 ), α-атомы водорода могут реагировать с сильными основаниями с образованием анионов. Необычная кислотность α-атомов водорода может быть объяснена как электроноакцепторной способностью карбоновой группы, так и резонансом в образующемся анионе. Электроноакцепторная способность карбонильной группы вызвана дипольной природой группы, которая возникает из-за различий в электроотрицательности углерода и кислорода.
Анион, образованный потерей α-водорода, может быть стабилизирован резонансом благодаря подвижности π-электронов, находящихся на соседней карбонильной группе.
Резонанс, который стабилизирует анион, создает две резонансные структуры - енольную и кето-форму. В большинстве случаев кето-форма более устойчива.
Галогенирование кетонов
В присутствии основания кетоны с α-атомами водорода реагируют с образованием α-галогенкетонов.
Аналогичным образом, когда метилкетоны реагируют с йодом в присутствии основания, происходит полное галогенирование.
Образование гипойодата натрия в растворе в результате реакции йода с гидроксидом натрия приводит к образованию йодоформа и бензоата натрия, как показано здесь.
Поскольку йодоформ представляет собой бледно-желтое твердое вещество, эту реакцию часто проводят как тест на метилкетоны и называют тестом на йодоформ .
Альдольная конденсация
Альдегиды, содержащие α-атомы водорода, реагируют сами с собой при смешивании с разбавленной водной кислотой или основанием. Полученные соединения, β-гидроксиальдегиды, упоминаются как альдольные соединения , потому что они обладают как альдегидной, так и спиртовой функциональной группой.
Альдольная конденсация протекает через промежуточный карбанион. Механизм альдольной конденсации, катализируемой основанием, включает следующие этапы:
1.Основание удаляет α-водород.
2. Карбанион подвергается нуклеофильному присоединению с карбонильной группой второй молекулы этаналя, что приводит к образованию продукта конденсации.
3. Реакция с водой протонирует алкоксид-ион.
Если альдол нагреть в основном растворе, молекула может быть дегидратирована с образованием α β-ненасыщенного альдегида.
Кросс-альдольная конденсация
Альдольная конденсация между двумя разными альдегидами дает кросс-альдольную конденсацию.Если оба альдегида содержат α-атомы водорода, образуется ряд продуктов. Чтобы быть полезным, кросс-альдол должен проходить между альдегидом, имеющим α-водород, и вторым альдегидом, не имеющим α-атомов водорода.
Кетоново-альдольная конденсация
Кетоны менее реактивны по отношению к альдольной конденсации, чем альдегиды. Однако с кислотными катализаторами могут образовываться небольшие количества альдольного продукта. Но образующийся альдол будет быстро дегидратировать с образованием резонансно-стабилизированного продукта.Эта стадия дегидратации доводит реакцию до завершения.
Катализируемая кислотой альдольная конденсация включает два ключевых этапа: преобразование кетона в его енольную форму и атаку енолом на протонированную карбонильную группу. Механизм работает следующим образом:
1. Кислород карбонильной группы протонирован.
2. Молекула воды, действующая как основание, удаляет кислый α-водород, что приводит к енолу.
3.Енол атакует протонированную карбонильную группу второй молекулы кетона.
Циклизация альдольной конденсацией
Внутренняя альдольная конденсация (конденсация, при которой обе карбонильные группы находятся в одной цепи) приводит к образованию кольца.
Механизм циклизации через альдол протекает через атаку енолятом карбонила альдегида.
1. Гидроксиион удаляет ион водорода α до карбонила кетона.
2. Енолят-ион атакует карбонил альдегида, замыкая кольцо.
3. Ион алкоксида отрывает протон от воды в кислотно-щелочной реакции.
4. Основание удаляет ион водорода с образованием резонансно-стабилизированной молекулы.
Бензоиновая конденсация
Ароматические альдегиды образуют продукт конденсации при нагревании с ионом цианида, растворенным в водно-спиртовом растворе.Эта конденсация приводит к образованию α-гидроксикетонов.
Цианид-ион - единственный известный катализатор этой конденсации, потому что цианид-ион обладает уникальными свойствами. Например, ионы цианида являются относительно сильными нуклеофилами, а также хорошими уходящими группами. Аналогичным образом, когда цианид-ион связывается с карбонильной группой альдегида, образующийся промежуточный продукт стабилизируется за счет резонанса между молекулой и цианид-ионом. Следующий механизм иллюстрирует эти моменты.
Реакция конденсации бензоина протекает через нуклеофильное замещение с последующей реакцией перегруппировки.
.1. Цианид-ион притягивается к атому углерода карбонильной группы.
2. Карбанион имеет резонансную стабилизацию.
3. Карбанион атакует вторую молекулу бензальдегида.
4. Ион алкоксида удаляет протон из гидроксидной группы.
5.Пара электронов на ионе алкоксида притягивается к углероду, связанному с цианидной группой, которая затем уходит с образованием продукта.
| ВВЕДЕНИЕ АЛЬДЕГИДЫ И КЕТОНЫ На этой странице объясняется, что такое альдегиды и кетоны, и рассматривается, как их связывание влияет на их реакционную способность. Также учитываются их простые физические свойства, такие как растворимость и точки кипения. Подробности химических реакций альдегидов и кетонов описаны на отдельных страницах. Что такое альдегиды и кетоны? Альдегиды и кетоны в виде карбонильных соединений Альдегиды и кетоны - это простые соединения, которые содержат карбонильную группу - двойную связь углерод-кислород.Они просты в том смысле, что у них нет других реакционноспособных групп, таких как -OH или -Cl, связанных непосредственно с атомом углерода в карбонильной группе - как вы могли бы найти, например, в карбоновых кислотах, содержащих -COOH. Примеры альдегидов В альдегидах карбонильная группа имеет присоединенный к ней атом водорода вместе с
В этом разделе мы игнорируем те, которые содержат бензольные кольца. | |||||||||||||
| Примечание: Для этого нет особой причины. Просто если вы новичок в органической химии, возможно, вы еще не встречали никаких соединений с бензольными кольцами в них. Я просто пытаюсь не усугубить ваше замешательство! | |||||||||||||
|
Обратите внимание, что все они имеют один и тот же конец молекулы.Отличается только сложность другой присоединенной группы. Когда вы пишете формулы для них, альдегидная группа (карбонильная группа с присоединенным атомом водорода) всегда записывается как -CHO - , а не как как COH. Его легко спутать с алкоголем. Этаналь, например, записывается как CH 3 CHO; метанал как HCHO. Имя подсчитывает общее количество атомов углерода в самой длинной цепи, включая атом в карбонильной группе.Если у вас есть боковые группы, присоединенные к цепи, обратите внимание, что вы всегда считаете от атома углерода в карбонильной группе число 1. | |||||||||||||
| Примечание: Если вы не уверены в названиях органических соединений, вам действительно следует перейти по этой ссылке, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||
| Примеры кетонов В кетонах карбонильная группа имеет две присоединенные углеводородные группы .Опять же, это могут быть либо алкильные группы, либо группы, содержащие бензольные кольца. Опять же, для простоты мы сконцентрируемся на тех, которые содержат алкильные группы. Обратите внимание, что кетоны никогда не имеют атома водорода , присоединенного к карбонильной группе.
Пропанон обычно обозначается как CH 3 COCH 3 . Обратите внимание на необходимость нумерации более длинных кетонов. В пентаноне карбонильная группа может находиться в середине цепи или рядом с концом, давая либо пентан-3-он, либо пентан-2-он. Связывание и реакционная способность Связь в карбонильной группе Кислород гораздо более электроотрицателен, чем углерод, и поэтому имеет сильную тенденцию притягивать к себе электроны в связи углерод-кислород. Одна из двух пар электронов, образующих двойную связь углерод-кислород, еще легче притягивается к кислороду. Это делает двойную связь углерод-кислород очень полярной. | |||||||||||||
| Примечание: Если вы не уверены в электроотрицательности и полярности связи, перейдите по этой ссылке, прежде чем продолжить. Если вы действительно заинтересованы в понимании связи в двойной связи углерод-кислород, вы можете подробно изучить ее, перейдя по этой ссылке. Вы можете обнаружить, что переход по этой ссылке займет у вас некоторое время, потому что вам, вероятно, также придется изучить несколько страниц справочного материала. Используйте кнопку НАЗАД (или файл ИСТОРИИ или меню ПЕРЕЙТИ) в браузере, чтобы вернуться на эту страницу. | |||||||||||||
| Важные реакции карбонильной группы Слегка положительный атом углерода в карбонильной группе может быть атакован нуклеофилами .Нуклеофил - это отрицательно заряженный ион (например, цианид-ион, CN - ) или слегка отрицательно заряженная часть молекулы (например, неподеленная пара на атоме азота в аммиаке, NH 3 ). В процессе реакции двойная связь углерод-кислород разрывается. Конечным результатом всего этого является то, что карбонильная группа претерпевает реакций присоединения , за которыми часто следует потеря молекулы воды. Это дает реакцию, известную как присоединение-отщепление или конденсация .Вы найдете примеры простых реакций присоединения и добавления-исключения, если изучите меню альдегидов и кетонов (ссылка внизу страницы). И альдегиды, и кетоны содержат карбонильную группу. Это означает, что их реакции в этом отношении очень похожи. Где различаются альдегиды и кетоны Альдегид отличается от кетона наличием атома водорода, присоединенного к карбонильной группе. Благодаря этому альдегиды очень легко окисляются. Например, этаналь, CH 3 CHO, очень легко окисляется либо до этановой кислоты, CH 3 COOH, либо до ионов этаноата, CH 3 COO -. Кетоны не имеют атома водорода и устойчивы к окислению. Они окисляются только мощными окислителями, которые способны разрушать углерод-углеродные связи. Вы найдете обсуждение окисления альдегидов и кетонов, если перейдете по ссылке из меню альдегидов и кетонов (см. Внизу этой страницы). Физические свойства Точки кипения Метаналь - это газ (точка кипения -21 ° C), а этаналь имеет температуру кипения + 21 ° C. Это означает, что этаналь кипит при температуре, близкой к комнатной. Другие альдегиды и кетоны представляют собой жидкости, температура кипения которых повышается по мере увеличения размера молекул. Величина точки кипения определяется силой межмолекулярных сил. Ван-дер-Ваальсовые силы дисперсии Эти притяжения становятся сильнее по мере того, как молекулы становятся длиннее и имеют больше электронов.Это увеличивает размеры устанавливаемых временных диполей. Вот почему температуры кипения увеличиваются с увеличением числа атомов углерода в цепях - независимо от того, говорите ли вы об альдегидах или кетонах. | |||||||||||||
| Примечание: Если вас не устраивают межмолекулярные силы (особенно силы дисперсии Ван-дер-Ваальса и диполь-дипольные взаимодействия), тогда вам действительно следует перейти по этой ссылке, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||
| Диполь-дипольные аттракционы Ван-дер-Ваальса Как альдегиды, так и кетоны являются полярными молекулами из-за наличия двойной связи углерод-кислород. Помимо дисперсионных сил, между постоянными диполями на соседних молекулах также будет существовать притяжение. Это означает, что точки кипения будут выше, чем у углеводородов аналогичного размера, которые имеют только дисперсионные силы. Интересно сравнить три молекулы одинакового размера. Они имеют одинаковую длину и одинаковое (хотя и не одинаковое) количество электронов.
Обратите внимание, что альдегид (с диполь-дипольным притяжением, а также с дисперсионными силами) имеет температуру кипения выше, чем у алкана аналогичного размера, который имеет только дисперсионные силы. Однако температура кипения альдегида не такая высокая, как у спирта. В спирте существует водородная связь, а также два других вида межмолекулярного притяжения. Хотя альдегиды и кетоны являются очень полярными молекулами, у них нет атомов водорода, непосредственно связанных с кислородом, и поэтому они не могут связываться друг с другом водородом. | |||||||||||||
| Примечание: Если вы не уверены в водородных связях, было бы неплохо пройти по этой ссылке, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||
| Растворимость в воде Небольшие альдегиды и кетоны легко растворимы в воде, но растворимость падает с длиной цепи. Например, метаналь, этаналь и пропанон - обычные небольшие альдегиды и кетоны - смешиваются с водой во всех пропорциях. Причина растворимости в том, что, хотя альдегиды и кетоны не могут образовывать водородные связи между собой, они могут создавать водородные связи с молекулами воды. Один из слегка положительных атомов водорода в молекуле воды может быть достаточно притянут к одной из неподеленных пар на атоме кислорода альдегида или кетона для образования водородной связи.
Конечно, также будут существовать дисперсионные силы и диполь-дипольное притяжение между альдегидом или кетоном и молекулами воды. При образовании этих аттракционов высвобождается энергия, которая помогает поставлять энергию, необходимую для разделения молекул воды и молекул альдегида или кетона друг от друга, прежде чем они смогут смешаться вместе. По мере увеличения длины цепи углеводородные «хвосты» молекул (все углеводородные частицы, кроме карбонильной группы) начинают мешать. Вставая между молекулами воды, они разрывают относительно прочные водородные связи между молекулами воды, не заменяя их ничем таким же хорошим. Это делает процесс менее рентабельным с энергетической точки зрения, и поэтому растворимость снижается.
© Джим Кларк 2003 (изменено в ноябре 2015 г.) | |||||||||||||
альдегид | Определение, структура, примеры и факты
Альдегид , любой из класса органических соединений, в которых атом углерода имеет двойную связь с атомом кислорода, одинарную связь с атомом водорода и одинарную связь с другим атомом или группой атомов (обозначены R в общие химические формулы и структурные схемы). Двойная связь между углеродом и кислородом характерна для всех альдегидов и известна как карбонильная группа. Многие альдегиды имеют приятный запах, и, в принципе, они получены из спиртов путем дегидрирования (удаления водорода), в результате чего процесс получил название альдегид .
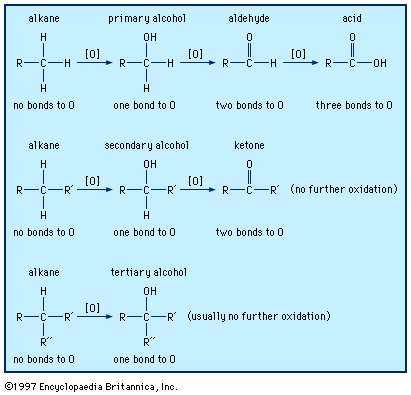 Спирты могут окисляться с образованием альдегидов, кетонов и карбоновых кислот. Окисление органических соединений обычно увеличивает количество связей углерода с кислородом и может уменьшать количество связей с водородом. Encyclopædia Britannica, Inc.
Спирты могут окисляться с образованием альдегидов, кетонов и карбоновых кислот. Окисление органических соединений обычно увеличивает количество связей углерода с кислородом и может уменьшать количество связей с водородом. Encyclopædia Britannica, Inc.
Альдегиды претерпевают широкий спектр химических реакций, включая полимеризацию. Их комбинация с другими типами молекул дает так называемые полимеры конденсации альдегида, которые использовались в пластмассах, таких как бакелит, и в ламинатном материале столешницы Formica.Альдегиды также полезны в качестве растворителей и ингредиентов духов и в качестве промежуточных продуктов при производстве красителей и фармацевтических препаратов. Некоторые альдегиды участвуют в физиологических процессах. Примерами являются сетчатка (альдегид витамина А), важный для зрения человека, и пиридоксальфосфат, одна из форм витамина B 6 . Глюкоза и другие так называемые восстанавливающие сахара являются альдегидами, как и несколько природных и синтетических гормонов.
Структура альдегидов
В формальдегиде, простейшем альдегиде, карбонильная группа связана с двумя атомами водорода.Во всех других альдегидах карбонильная группа связана с одним водородом и одной углеродной группой. В конденсированных структурных формулах карбонильная группа альдегида обычно представлена как CHO. Используя это соглашение, формула формальдегида - HCHO, а формула ацетальдегида - CH 3 CHO.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодня 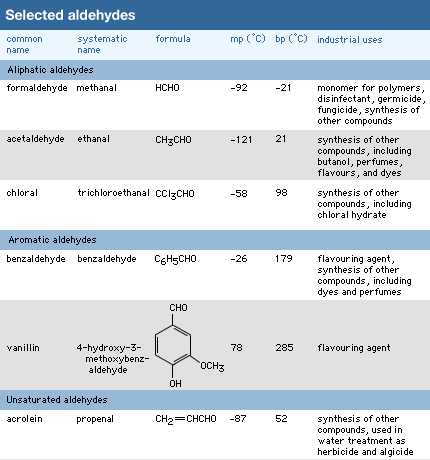 Атомы углерода, связанные с карбонильной группой альдегида, могут быть частью насыщенных или ненасыщенных алкильных групп, или они могут быть алициклическими, ароматическими или гетероциклическими кольцами.
Атомы углерода, связанные с карбонильной группой альдегида, могут быть частью насыщенных или ненасыщенных алкильных групп, или они могут быть алициклическими, ароматическими или гетероциклическими кольцами.
Есть два основных способа обозначения альдегидов. Первый метод основан на системе, используемой Международным союзом теоретической и прикладной химии (IUPAC), и часто упоминается как систематическая номенклатура. Этот метод предполагает самую длинную цепочку атомов углерода, которая содержит карбонильную группу в качестве исходного алкана. Альдегид обозначается изменением суффикса -e на -al. Поскольку карбонильная группа альдегида может находиться только на конце родительской цепи и, следовательно, должна быть углеродом 1, нет необходимости использовать номер для ее определения.
В соединении под названием 4-метилпентаналь самая длинная углеродная цепь содержит пять атомов углерода, поэтому исходное название - пентан; суффикс -al добавляется для обозначения присутствия альдегидной группы, и цепь нумеруется, начиная с карбонильной группы. Метильной группе присвоено число 4, потому что она связана с четвертым углеродом цепи.
Другой метод номенклатуры альдегидов, называемый общей номенклатурой, состоит в том, чтобы назвать их после общего названия соответствующей карбоновой кислоты; я.е. карбоновая кислота с той же структурой, что и альдегид, за исключением того, что COOH появляется вместо CHO. Кислоты обычно получают названия, оканчивающиеся на -иновой кислоте. Альдегиды имеют то же название, но суффикс -иновая кислота заменен на -альдегид. Два примера - формальдегид и бензальдегид.
В качестве другого примера, общее название CH 2 = CHCHO, для которого название IUPAC - 2-пропенал, представляет собой акролеин, название, производное от акриловой кислоты, исходной карбоновой кислоты.
.










