Щелочь в каких продуктах
Какие продукты питания считаются щелочными: список, полная таблица
Человек может чувствовать себя молодым и здоровым только тогда, когда в его организме созданы все условия для правильного протекания обменно-восстановительных процессов и метаболизма. Главным показателем этих условий служит уровень кислотно-щелочного равновесия. Цифра 7 на шкале означает оптимальный уровень pH баланса. Все, что ниже 7, является кислотной средой, выше — щелочной. Для поддержания организма в тонусе специалисты настоятельно рекомендуют придерживаться щелочной диеты.
Польза щелочных продуктов
К основным достоинствам и полезным свойствам щелочных продуктов следует отнести следующее:
- вывод шлаков и токсинов;
- обогащение организма витаминами и важными микроэлементами;
- создание оптимальных условий развития клеток;
- быстрое усваивание организмом;
- помощь в борьбе с различными заболеваниями внутренних органов;
- быстрое и правильное похудение;
- улучшение состояния кожи, ногтей и волос.
Особенности питания
Накопленные в организме токсины и шлаки оказывают на него кислотное воздействие. Для нормализации pH показателя в рацион стоит включить щелочные продукты.
В своем составе щелочные продукты содержат:
- кальций;
- медь;
- магний;
- железо;
- калий;
- натрий;
- марганец.
Организм, который недополучает ощелачивающие продукты, становится обладателем:
- углекислого газа;
- серы;
- фосфора;
- хлора;
- йода.
Диетологи рекомендуют включать в ежедневный рацион щелочных продуктов в 2 раза больше, чем кислотных.
Замечания
Для поддержания оптимального уровня щелочности крови человеку необходимо употреблять в день 80% щелочи и 20% кислоты. Некоторые продукты питания, попадая в организм и проходя все этапы пищеварения и метаболизма, могут оставлять в организме щелочные отходы и кислотные. Они называются щелочно-генными и кислотно-генными. К ним можно отнести:
- Пшеничная мука, нешлифованный рис, а также некоторые другие хлебные злаки в натуральном виде являются умеренно кислотными. Но при попадании в организм или при обработке становятся более кислыми.
- Все виды хлебных злаков, бобовых, мясных продуктов и яиц по своей природе являются кислотными. А овощи и фрукты — щелочными.
- Все цитрусовые изначально ассоциируются с кислыми продуктами. Однако, перерабатываясь в организме, они оказывают щелочное воздействие.
- Бобовые плоды относятся к категории кислых продуктов. Но проращенные бобовые становятся более щелочными.
- Молоко является щелочным продуктом только в сыром виде. Нагретое, кипяченое молоко, все молочные продукты будут относиться к кислотным.
Список продуктов питания
Для сбалансированного питания рекомендуется употреблять продукты с низким или средним кислотно-щелочным показателем. Ниже представлена полная таблица часто употребляемых продуктов питания.
Щелочные продукты
Список высокощелочных продуктов:
| Продукт | Состав |
| Овощи | Репчатый лук, сладкий картофель |
| Фрукты | Лимон, лайм, хурма, нектарин, ананас, мандарин |
| Ягоды | Арбуз |
| Крупы, семечки | Чечевица, тыквенные семечки |
| Вода | Минеральная вода |
| Водоросли | Красные водоросли, морская капуста, спирулина |
| Другое | Пищевая сода, морская соль |
Список среднещелочных продуктов:
| Продукт | Состав |
| Овощи | Руккола, спаржа, брокколи, морковь, кайенский перец, чеснок, имбирь, горох |
| Фрукты | Яблоко, абрикос, мускусная дыня, апельсин, грейпфрут, киви, манго, маракуйа |
| Ягоды | Малина |
| Крупы, семечки, орехи | Кешью, каштан, |
| Зелень | Петрушка, укроп, зеленый лук |
| Вода | Женьшеневый чай, травяной чай |
| Другое | Падевый мед, патока, соевый соус |
Список продуктов, содержащих щелочь на низком уровне:
| Продукт | Состав |
| Овощи | Артишоки, болгарский перец, авокадо, капуста белокочанная, цветная, баклажан, грибы, лук-порей, картофель, тыква, редис |
| Фрукты | Зеленые яблоки, вишня, папайя, персик, груша |
| Ягоды | Ежевика |
| Крупы, семечки, орехи | Миндаль |
| Мясные продукты, яйца | Куриные яйца, перепелиные яйца |
| Вода | Зеленый чай |
| Другое | Яблочный уксус, рисовый уксус, мед |
Список очень низкощелочных продуктов:
| Продукт | Состав |
| Овощи | Свекла, брюссельская капуста, сельдерей, квашеная капуста, огурец, салат-латук, кабачки, репа |
| Фрукты | Банан, виноград, клубника |
| Ягоды | Черника, смородина |
| Крупы, семечки | Овес, проросшие семена, семена подсолнуха |
| Вода | Имбирный чай, топленое молоко, натуральный кофе |
| Другое | Масло авокадо, масло кокоса, кинза, кунжут, топленое масло, кунжутная паста |
Кислотные продукты
Все продукты можно классифицировать на менее и более кислотные:
| Продукт/Кислотность | Высококислотные | Среднекислотные | Низкокислотные |
| Овощи | Соя | Оливки, бобовые | Фасоль стручковая и спаржевая, помидор |
| Фрукты | Фруктовые соки | Гранат, чернослив | Слива, сухофрукты, инжир |
| Ягоды | — | Клюква | — |
| Мясные, молочные продукты, яйца, морепродукты | Говядина, йогурт, плавленый сыр, молоко, морепродукты | Курица, творог, куриный белок, свинина, кальмар, телятина | Сыр, коровье и козье молоко, индейка, гусятина, баранина, раки |
| Крупы, семечки, орехи, макаронные изделия | Бразильский орех, грецкий орех, фундук, макароны | Ячмень, белый рис, нут, горох, мускатный орех, отруби, макаронные изделия из высших сортов муки, арахис, фисташки, рожь | Гречка, манка, бурый рис, кедровый орех |
| Зелень | — | — | Шпинат |
| Вода | Пиво, вино, какао, безалкогольные напитки | Соевое молоко | Водка, черный чай |
| Сладости | Джем, желе, белый и коричневый сахар, мороженое | Пастеризованный мед | — |
| Мучное | Белый хлеб, пшеничная мука | Выпечка | — |
| Другое | Уксус, хлопковое масло, хмель, соль | Горчица, кетчуп | Масло миндаля, бальзамический уксус, крахмал, ванилин |
Популярные щелочные продукты
Среди всех щелочных продуктов питания существуют те, которые ощелачивают организм гораздо больше и быстрее. К ним относят следующие:
| Продукт | Полезные свойства |
| Лимон | Является самым щелочным продуктом. Он незаменим при простуде, вирусных заболеваниях и изжоге. Он помогает бороться не только с повышенной кислотностью, но и является природным антисептиком |
| Листовая свекла | Незаменима при заболеваниях сердечно-сосудистой системы, а также проблемах со зрением и памятью. Листья швейцарского мангольда насыщены клетчаткой, белками, витаминами и минеральными солями |
| Огурец | Помогает в короткие сроки нормализовать процесс пищеварения и нейтрализовать кислотную среду в органах ЖКТ. Также он будет полезен людям, страдающим от кожных высыпаний |
| Редис | Налаживает перистальтику кишечника, снижает уровень холестерина и активизирует обменные процессы. Он является хорошим помощником в борьбе с кожными заболеваниями |
| Сельдерей | Способен замедлить процесс старения и увядания кожи, он улучшает водно-солевой баланс и нормализует уровень сахара в крови. В корне и листьях сельдерея содержится большое количество витаминов, минералов, аминокислот и эфирных масел |
| Чеснок | Является важным звеном в поддержании иммунитета. Он обладает высокими противомикробными свойствами |
| Свекла | Обладает практически всеми витаминами, включая минералы и клетчатку. Ее полезные свойства благотворно влияют на работу органов ЖКТ |
| Авокадо | Благодаря наличию в его составе мононенасыщенных кислот укрепляет сердечно-сосудистую систему и способствует нормализации кислотно-щелочного баланса |
| Дыня | Содержит высокий показатель кислотности (8,5). Она незаменима при мочекаменной болезни, болезнях почек и простудных заболеваниях. Употребление ее перед сном поможет навсегда забыть о бессоннице и стрессе |
| Гречка | Так же, как и свекла, помогает справиться с проблемами сердечно-сосудистой системы |
| Банан | Благодаря высокому содержанию в своем составе пектина и крахмала способен быстро наладить работу органов пищеварения |
| Ягоды | Содержат большое количество клетчатки, которая необходимо для работы кишечника |
| Брокколи | Разновидность капусты богата витаминами и микроэлементами, необходимыми для работы печени и почек |
| Ананас | Богат витаминами группы А и С. Он помогает победить ангину, артрит, предупреждает развитие атеросклероза и ускоряет процесс заживления ран. Его сок специалисты рекомендуют употреблять для укрепления памяти |
| Виноград | Укрепляет иммунитет и снижает риск онкологических заболеваний. Он полезен для нервной системы, поскольку помогает избавиться от стресса, негативных реакций организма на внешние раздражители и нормализует сон |
| Шпинат | Помогает справиться с диабетом, астмой, анемией и онкологией. Если включить в свой рацион этот продукт, то скоро можно будет увидеть улучшение состояния волос, ногтей и кожи |
Советы доктора И. П. Неумывакина
Профессор в одной из своих лекций говорил, что на сегодняшний день почти каждый второй человек страдает от повышенной кислотности организма. Эта проблема связана с наличием в пище, воздухе и воде ядов, пестицидов и выхлопных газов автомобилей. Отсюда у человека происходят различные психические расстройства, а также беспричинный страх, апатия, раздражение, депрессия, злоба. Длительное употребление лекарственных препаратов также негативным образом сказывается на состоянии организма.
Для борьбы с подобной проблемой Неумывакин предлагает обыкновенную пищевую соду. Применяют ее следующим образом:
- В первые три дня пациент употребляет 0,5 ч. л. соды. Ее можно разбавить прохладной водой или молоком или просто запить. Кипятить жидкость не нужно.
- Затем делается перерыв на 3 дня.
- После доза увеличивается до 1 ч. л. Пьется таким же курсом.
- Если улучшение не наступает, соду можно пить еще и днем перед едой.
Применять соду Неумывакин рекомендовал людям, страдающим:
- алкоголизмом;
- тягой к курению и наркомании;
- заболеваниями двигательного аппарата;
- мочекаменной и желчекаменной болезнями.
Соду следует употреблять людям, работающим на предприятиях с повышенным содержание металлов: свинца, ртути, таллия, висмута, бария, кадмия.
Simple English Wikipedia, бесплатная энциклопедия
В химии щелочь представляет собой водный (полученный из воды) раствор со значением pH более 7. Слово «щелочь» происходит от арабского «кали», что означает «из пепла», поскольку зола, смешанная с водой, используемая в качестве чистящих средств (например, мыла), состоит из щелочных материалов.
Щелочь - это основание, растворенное в воде. Часто это соль щелочного металла
. Щелочь является противоположностью кислоты и может быть нейтрализована (снижена до pH 7) добавлением кислоты.
- На ощупь мыльный
- едкое вещество (может обжечь кожу)
- Чем выше число более 7 по шкале pH, тем сильнее щелочь.
- Хорошо растворим (растворяется) в воде
- Они горькие на вкус
- Превращает красную лакмусовую бумагу в синий
- Может проводить электричество из-за наличия подвижных ионов
- Синий или фиолетовый на универсальном индикаторе
Подобно кислотам, щелочи могут быть слабыми или сильными, в зависимости от природы и концентрации ионной соли, составляющей их.Прочность щелочи можно определить с помощью универсального индикатора. Как и кислоты, сила щелочи оценивается с помощью шкалы pH.
Например, мыло и зубная паста содержат слабые щелочи, а чистящие средства часто содержат сильные.
Оксиды металлов и гидроксиды металлов - это два типа оснований. При нейтрализации (добавлении кислоты) они производят соль и воду. Тип производимой соли зависит от кислоты и основания.
.Щелочь | химическое соединение | Britannica
Щелочь , любой из растворимых гидроксидов щелочных металлов - , то есть лития, натрия, калия, рубидия и цезия. Щелочи - это сильные основания, которые превращают лакмусовую бумажку из красной в синюю; они реагируют с кислотами с образованием нейтральных солей; они едкие и в концентрированном виде вызывают коррозию органических тканей. Термин «щелочь» также применяется к растворимым гидроксидам таких щелочноземельных металлов, как кальций, стронций и барий, а также к гидроксиду аммония.Первоначально этот термин применялся к золе сгоревших натрий- или калийсодержащих растений, из которой можно было выщелачивать оксиды натрия и калия.
 щелочь
щелочь Натрий металлический.
Денис "С.К."Подробнее по этой теме
мыло и моющее средство: Щелочь
Гидроксид натрия используется в качестве омыляющей щелочи для большей части производимого сейчас мыла.Мыло также может производиться с гидроксидом калия ...
Производство промышленной щелочи обычно относится к производству кальцинированной соды (Na 2 CO 3 ; карбонат натрия) и каустической соды (NaOH; гидроксид натрия). Другие промышленные щелочи включают гидроксид калия, поташ и щелочь. Производство широкого спектра потребительских товаров зависит от использования на определенном этапе щелочи. Кальцинированная сода и каустическая сода необходимы для производства стекла, мыла, различных химикатов, вискозы и целлофана, бумаги и целлюлозы, чистящих и моющих средств, текстильных изделий, смягчителей воды, некоторых металлов (особенно алюминия), бикарбоната соды, бензина и других материалов. нефтепродукты.
Люди использовали щелочь на протяжении веков, сначала получая ее в результате выщелачивания (водных растворов) некоторых пустынных земель. В конце 18 века выщелачивание золы из древесины или морских водорослей стало основным источником щелочи. В 1775 году Французская Академия наук предложила денежные премии за новые методы производства щелочи. Приз за кальцинированную соду получил француз Николя Леблан, который в 1791 году запатентовал процесс преобразования поваренной соли (хлорида натрия) в карбонат натрия.Процесс Леблана доминировал в мировом производстве до конца XIX века, но после Первой мировой войны он был полностью вытеснен другим процессом переработки соли, который был усовершенствован в 1860-х годах Эрнестом Сольвеем из Бельгии. В конце XIX века появились электролитические методы производства каустической соды, значение которых быстро возросло.
В процессе Solvay или аммиачно-содового процесса ( q.v.) производства кальцинированной соды поваренная соль в виде сильного рассола химически обрабатывается для удаления примесей кальция и магния, а затем насыщается рециркуляционным газообразным аммиаком в колоннах.Затем аммонизированный рассол карбонизируют с использованием газообразного диоксида углерода при умеренном давлении в колонне другого типа. Эти два процесса дают бикарбонат аммония и хлорид натрия, двойное разложение которых дает желаемый бикарбонат натрия, а также хлорид аммония. Затем бикарбонат натрия нагревают, чтобы разложить его до желаемого карбоната натрия. Аммиак, участвующий в процессе, почти полностью восстанавливается обработкой хлорида аммония известью с получением аммиака и хлорида кальция.Затем рекуперированный аммиак повторно используется в уже описанных процессах.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодняЭлектролитическое производство каустической соды включает электролиз сильного солевого раствора в электролитической ячейке. (Электролиз - это расщепление соединения в растворе на его составляющие с помощью электрического тока с целью вызвать химическое изменение.) Электролиз хлорида натрия дает хлор и либо гидроксид натрия, либо металлический натрий.Гидроксид натрия в некоторых случаях конкурирует с карбонатом натрия в тех же сферах применения, и в любом случае они взаимно превращаются посредством довольно простых процессов. Хлорид натрия можно превратить в щелочь с помощью любого из двух процессов, разница между ними заключается в том, что процесс аммиачно-содовой дает хлор в форме хлорида кальция, соединения, имеющего небольшую экономическую ценность, а электролитические процессы производят элементарный хлор , который находит бесчисленное множество применений в химической промышленности.По этой причине аммиачно-содовый процесс, вытеснивший процесс Леблана, оказался вытесненным, старые аммиачно-содовые заводы продолжают работать очень эффективно, в то время как новые заводы используют электролитические процессы.
В нескольких местах в мире есть значительные залежи минеральной формы кальцинированной соды, известной как природная щелочь. Минерал обычно представляет собой сесквикарбонат натрия или трону (Na 2 CO 3 · NaHCO 3 · 2H 2 O).Соединенные Штаты производят большую часть мировой природной щелочи из обширных залежей троны в подземных рудниках в Вайоминге и из высохших озер в Калифорнии.
.Разница между щелочью и основанием с подробным сравнением
-
- БЕСПЛАТНАЯ ЗАПИСЬ КЛАСС
- КОНКУРСНЫЕ ЭКЗАМЕНА
- BNAT
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 110003 CBSE
- Книги NCERT
- Книги NCERT для класса 5
- Книги NCERT, класс 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- NCERT Книги для класса 11
- NCERT Книги для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11 9plar
- RS Aggarwal
- Решения RS Aggarwal класса 12
- Решения RS Aggarwal класса 11
- RS Aggarwal Решения класса 10
- Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- RD Sharma
- RD Sharma Class 6 Решения
- RD Sharma Class 7 Решения
- Решения RD Sharma класса 8
- Решения RD Sharma класса 9
- Решения RD Sharma класса 10
- Решения RD Sharma класса 11
- Решения RD Sharma Class 12
- PHYSICS
- Механика
- Оптика
- Термодинамика
- Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Статистика
- 9000 Pro Числа
- Числа
- 9000 Pro Числа Тр Игонометрические функции
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убытки
- Полиномиальные уравнения
- Деление фракций
- Microology 0003000
- Книги NCERT
- FORMULAS
- Математические формулы
- Алгебраные формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы 0003000
- 000 CALCULATORS
- 000
- 000 Калькуляторы по химии 900 Образцы документов для класса 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 1 1
- Образцы документов CBSE для класса 12
- Вопросники предыдущего года CBSE
- Вопросники предыдущего года CBSE, класс 10
- Вопросники предыдущего года CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Класс 11 Физика
- HC Verma Solutions Класс 12 Физика
- Решения Лакмира Сингха
- Решения Лахмира Сингха класса 9
- Решения Лахмира Сингха класса 10
- Решения Лакмира Сингха класса 8
9000 Класс
- Дополнительные вопросы по математике для класса 8 CBSE
- Дополнительные вопросы по науке для класса 8 CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Вопросы
- CBSE Class 10 Дополнительные вопросы по математике
- CBSE Class 10 Science Extra questions
- Class 3
- Class 4
- Class 5
- Class 6
- Class 7
- Class 8 Класс 9
- Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия
- Решения NCERT для биологии класса 11
- Решение NCERT s Для класса 11 по математике
- NCERT Solutions Class 11 Accountancy
- NCERT Solutions Class 11 Business Studies
- NCERT Solutions Class 11 Economics
- NCERT Solutions Class 11 Statistics
- NCERT Solutions Class 11 Commerce
- NCERT Solutions for Class 12
- Решения NCERT для физики класса 12
- Решения NCERT для химии класса 12
- Решения NCERT для биологии класса 12
- Решения NCERT для математики класса 12
- Решения NCERT, класс 12, бухгалтерия
- Решения NCERT, класс 12, бизнес-исследования
- NCERT Solutions Class 12 Economics
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- NCERT Solut Ионы Для класса 4
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для класса 5
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для класса 6
- Решения NCERT для математики класса 6
- Решения NCERT для науки класса 6
- Решения NCERT для класса 6 по социальным наукам
- Решения NCERT для класса 6 Английский язык
- Решения NCERT для класса 7
- Решения NCERT для математики класса 7
- Решения NCERT для науки класса 7
- Решения NCERT для социальных наук класса 7
- Решения NCERT для класса 7 Английский язык
- Решения NCERT для класса 8
- Решения NCERT для математики класса 8
- Решения NCERT для науки 8 класса
- Решения NCERT для социальных наук 8 класса ce
- Решения NCERT для класса 8 Английский
- Решения NCERT для класса 9
- Решения NCERT для класса 9 по социальным наукам
- Решения NCERT для математики класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для математики класса 9, глава 2 Решения NCERT
- для математики класса 9, глава 3
- Решения NCERT для математики класса 9, глава 4
- Решения NCERT для математики класса 9, глава 5 Решения NCERT
- для математики класса 9, глава 6
- Решения NCERT для математики класса 9, глава 7 Решения NCERT
- для математики класса 9, глава 8
- Решения NCERT для математики класса 9, глава 9
- Решения NCERT для математики класса 9, глава 10 Решения NCERT
- для математики класса 9, глава 11 Решения
- NCERT для математики класса 9 Глава 12 Решения NCERT
- для математики класса 9 Глава 13
- NCER Решения T для математики класса 9 Глава 14
- Решения NCERT для математики класса 9 Глава 15
- Решения NCERT для науки класса 9
- Решения NCERT для науки класса 9 Глава 1
- Решения NCERT для науки класса 9 Глава 2
- Решения NCERT для науки класса 9 Глава 3 Решения NCERT
- для науки класса 9 Глава 4
- NCERT Sol
Определение щелочного металла, расположение в периодической таблице, свойства
Определение: что такое щелочные металлы
Щелочные металлы, также известные как семейство щелочных металлов, представляют собой группу из шести элементов, характеризующихся общими физическими и химическими свойствами, схожей электронной конфигурацией и общими периодическими тенденциями. Все щелочные металлы встречаются в природе, но, поскольку они обладают высокой реакционной способностью, они не встречаются свободно в чистом виде [1] .

Пример щелочного металла Натрий
Где находятся щелочные металлы в Периодической таблице
Они находятся в группе 1 (первый столбец слева) периодической таблицы.Все щелочные металлы находятся в s-блоке, поскольку электрон на внешней оболочке их атома (валентный электрон) находится на s-орбитали [2, 3]
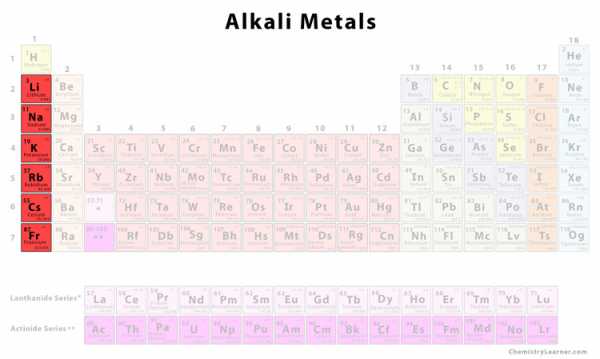
Щелочные металлы на первичном столе
Почему они называются щелочными металлами
Когда элементы группы 1 реагируют с водой, все они образуют щелочные растворы. Итак, семейство щелочных металлов называется семейством [4] .
Общие свойства и характеристики щелочных металлов
Физические свойства
Общие металлические свойства
- Серебристого цвета с блестящим внешним видом [2]
- Хорошая тепло- и электропроводность
Необычные неметаллические свойства, разделяемые элементами группы 1
- Достаточно мягкий, чтобы его можно было разрезать пластиковым ножом при комнатной температуре [5]
- Низкие температуры плавления и кипения [6]
- Низкая плотность (Li, Na и K, достаточно легкие, чтобы плавать в воде)
Химические свойства
- Все щелочные металлы обладают высокой реакционной способностью
Почему щелочные металлы настолько реактивны
Наличие одного валентного электрона (электрона на внешней оболочке их атома) делает все щелочные металлы очень реактивными при комнатной температуре и стандартном давлении .Им требуется мало энергии, чтобы потерять электрон и образовать положительно заряженные ионы (катионы) с зарядом +1.
Электронная конфигурация щелочных металлов
Эти элементы легко вступают в реакцию даже с кислородом воздуха с образованием оксидов, из-за которых их блестящая поверхность становится бледно-серой в считанные секунды, если их оставить на открытом воздухе [7] .
Как щелочные металлы реагируют с водой
Когда щелочной металл, например натрий (Na) контактирует с водой, единственный валентный электрон покидает атом натрия, и в результате реакции образуются гидроксид и ионы натрия вместе с водородом [5] :
Na 2 + 2H 2 O -> H 2 + 2Na + + 2OH -
Ионы Na + и OH - довольно нестабильны в водном растворе, поэтому они образуют гидроксид натрия [4].Окончательное уравнение выглядит следующим образом:
Na 2 + 2H 2 O -> H 2 + 2NaOH
Примеры реакции некоторых других щелочных металлов с водой:
2K + 2H 2 O -> H 2 + 2KOH
2Li + 2H 2 O -> H 2 + 2LiOH
2Rb + 2H 2 O -> H 2 + 2RbOH
Тепло, образующееся в результате реакции, воспламеняет образующиеся атомы водорода, вызывая значительный взрыв [8] .
Периодические тенденции щелочных металлов
В нижнюю группу 1 периодической таблицы, которую вы перемещаете, для щелочных металлов очевидны следующие тенденции:
- Понижение температуры плавления и кипения [4]
- Увеличивающаяся плотность и вес , где Li - самый легкий, а Fr - самый тяжелый (хотя натрий и калий являются исключением, поскольку последний менее плотный, чем первый) [2]
- Увеличение атомного радиуса
- Повышение реакционной способности (из-за увеличения атомного радиуса легче выбить валентный электрон в элементах, расположенных ниже по группе, что делает Li наименее реактивным, а франций - наиболее реактивным щелочным металлом) [2]
Видео: реакционная способность и периодические тенденции щелочных металлов
Какие щелочные металлы используются для
Три верхних элемента группы, Li, Na и K, наряду с Cs, находят различное применение в различных отраслях промышленности, включая производство стекла, фотографию, производство оружия и взрывчатых веществ, а также аккумуляторы. Соединения натрия находят повседневное применение в пищевой промышленности. .Rb в основном используется в исследовательских целях [10] . Fr не имеет постоянного применения, так как редко встречается в природе [5] .
FAQ
1. Почему щелочные металлы хранятся в масле?
Отв. Щелочные металлы в чистом виде обладают высокой реакционной способностью и должны храниться в масле, чтобы они не контактировали с воздухом и водой. [2] .
2. Какие щелочные металлы наиболее распространены?
Отв. Натрий и калий - самые распространенные щелочные металлы.
3. Почему водород не считается щелочным металлом?
Отв. Несмотря на наличие единственного электрона во внешней оболочке, водород (H) не считается щелочным металлом, потому что:
- H не металл, это газ.
- Он также гораздо менее реактивен, ему требуется больше энергии для высвобождения этого единственного электрона для образования положительно заряженных ионов.
- H также может получить электрон для образования отрицательно заряженных ионов, как элементы в галогенной группе [17] .
4. Чем отличаются щелочные металлы от щелочноземельных металлов?
Отв. Щелочноземельные металлы - это элементы 2 группы в периодической таблице. Несмотря на некоторое сходство в своих физических свойствах, они помещены в разные группы главным образом потому, что щелочноземельные металлы имеют два электрона на внешней оболочке их атома. Поскольку потеря 2 электронов требует больше энергии, чем потеря одного, щелочноземельные металлы менее реактивны, чем щелочные металлы [13] .
5. Почему галогены и щелочные металлы могут образовывать ионы?
Отв. Имея 1 валентный электрон, щелочные металлы пытаются избавиться от него для достижения стабильности, в то время как галогены (например, хлор, бром, фтор и т.д.) имеют семь валентных электронов, то есть они пытаются получить еще 1 электрон, чтобы стать стабильными. В результате вместе они реагируют с образованием ионных соединений, таких как хлорид натрия (NaCl) и хлорид калия (Kcl) [14] .
6.Чем щелочные металлы отличаются от благородных газов?
Отв. Щелочные металлы имеют один электрон на своей внешней оболочке, в то время как все благородные газы (элементы 8 группы в периодической таблице, включая гелий, неон, аргон) имеют полную валентную зону без неспаренного электрона, который мог бы вызвать реакцию с другими молекулами [15] .
Интересные факты
- Название группы щелочных металлов происходит от арабского слова «аль-кали», что означает «из пепла».Он был назван так потому, что большинство соединений Na и K были первоначально получены из древесной золы [16] .
- Элементы этой группы имеют самую низкую энергию первой ионизации (минимальную энергию, необходимую для того, чтобы атом отдал электрон) в каждый период [12] .
Артикул:
- Определение щелочного металла (химия) - Thoughtco.com
- Щелочные металлы - Courses.LumenLearning.com
- Таблица Менделеева - ModelScience.com
- Группа 1 - Щелочные металлы ―BBC.com
- Элементы щелочных металлов: свойства, характеристики и реакции - Study.com
- Точки плавления и кипения щелочных металлов - Embibe.com
- Объекты группы 1 - BBC.co.uk
- Информация о щелочных металлах - EHS.Stanford.edu
- Повседневное использование щелочных металлов - SchooledbyScience.com
- Щелочные металлы - ScienceClarified.com
- Щелочные металлы - Open.edu
- Щелочные металлы - Tutorvista.com
- Щелочные и щелочноземельные металлы - TechnologyUK.net
- Щелочные металлы - Hyperphysics.phy-astr.gsu.edu
- Объясните, чем щелочные металлы отличаются от благородных газов? - Study.com
- Групповые тенденции: активные металлы - Mikeblaber.org
- Сходство водорода со щелочными металлами - Embibe.com