Бром в каких продуктах содержится
Бром (Br) в продуктах питания и его роль в организме человека
Как и другие микроэлементы, бром является важным компонентом для здорового функционирования организма человека. Как нехватка, так и избыток брома может спровоцировать серьезные проблемы.
Общая характеристика
Бром распространен в природе очень широко. Особенно много его в соленой воде, есть он также в растениях и горных породах. В чистом виде он представляет собой густую едкую жидкость темно-красного цвета с очень неприятным запахом.
Открыт микроэлемент был в первой половине 19 столетия, и одновременно его представили миру два ученых – французский химик Антуан Жером Балар и немец Карл Якоб Лёвих. Причем первый сначала назвал элемент муридом (в переводе – рассол), поскольку открыл он его при изучении соляных промыслов Средиземного моря.
Биологическая роль брома в организме человека
В организме взрослого здорового человека находится около 200-300 мкг брома. Его содержат почки, гипофиз, щитовидная железа, ткани мышц и костей, а также кровь. Микроэлемент принимает активное участие в таких процессах организма:
- активизирует пепсин;
- активизирует определенные ферменты, такие как липазы и амилазы;
- оказывает влияние на щитовидную железу;
- принимает участие в регуляции нервной системы;
- активизирует половые функции.
Биологическая роль брома в организме была доказана далеко не сразу. В наше время известно, что он способствует регуляции процессов торможения и возбуждения нервной системы, в основном, в коре головного мозга, и обеспечивает правильный баланс. Ввиду этого он часто является компонентом успокаивающих средств. Поскольку бром – антагонист йода, он предотвращает гиперфункцию щитовидной железы, а также активизирует работу надпочечников. Принимает активное участие в обмене жиров и углеводов. Также существует предположение, что данный микроэлемент нужен для кроветворения.
Суточная потребность
Норма потребления брома в сутки для среднестатистического взрослого человека составляет 3-8 мг.
Полезные свойства брома
В виде бромидов микроэлемент используют для лечения различных заболеваний. Он обладает высоким седативным действием, ввиду чего препараты брома нередко показаны при нервных нарушениях и проблемах со сном. Соли брома эффективно используются для борьбы с болезнями, причиняющими судороги, а также при проблемах в работе сердечно-сосудистой системы, болезнях желудка и кишечника, в частности, язвенных заболеваний.
Для избавления от каловых камней, при употреблении «вредной пищи», применяется очистительная клизма. Читайте всё об очистительной клизме в домашних условиях — правила постановки и противопоказания, отзывы об использовании.
Узнайте, чем полезен гранат для вашего организма. Лечебные свойства гранатового сока и его кожуры.
Симптомы недостатка брома в организме
Нехватка брома в организме человека возможна в том случае, если он употребляет в пищу мало растительных продуктов, а также ввиду проживания в местностях, где содержание микроэлемента в окружающей среде низкое. Это горные области и регионы, далекие от моря. Симптомы недостатка бора в организме следующие:
- высокая раздражительность, склонность к истерикам;
- низкая половая активность;
- проблемы со сном, бессонница;
- замедленный рост у детей;
- пониженный уровень гемоглобина в крови;
- пониженная кислотность желудочного сока.
Недостаток брома в организме может стать причиной уменьшения длительности жизни, а также повышения рисков выкидыша при беременности. При постоянных симптомах недомогания не медлите с обращением к врачу.
Признаки избытка
Избыток брома обычно проявляется при передозировке препаратов, его содержащих, что крайне нежелательно. Среди признаков избытка брома:
- появление на коже воспалений и высыпаний;
- подавленность и общая слабость;
- проблемы в работе органов пищеварения;
- регулярный насморк и кашель, которые не имеют отношения к простуде и вирусам.
Соединения брома являются малотоксичными, в то время как элементарный бром – сильнейший яд. Даже незначительное превышение содержания брома в окружающей среде может стать причиной постоянных головокружений, раздражений слизистых дыхательных органов и глазных оболочек, кровотечений из носа. Если концентрации брома значительно выше нормы, возможны спазмы дыхательных путей и даже летальный исход из-за удушья. Смертельная доза для человека – 3 г брома.
Если бром попадает на кожу, может возникнуть очень сильный ожог. Регулярные отравления малыми дозами могут спровоцировать проблемы со сном и памятью, ухудшение пищеварения. В случае отравления бромом нужно как можно раньше вывести человека на воздух. При удушье можно использовать вату, смоченную в нашатыре. Дальше лечение должен осуществлять врач.
Бром в продуктах питания
Большую часть брома организм получает с продуктами питания. В связанном виде, будучи частью солей либо органических кислот, он является малотоксичным. Бром содержат бобовые, особенно фасоль, горох и чечевица, орехи, зерновые. Именно растительные продукты считаются главными его источниками. Содержится и в морепродуктах, и в морской рыбе. Есть он в поваренной каменной соли. Организм довольно хорошо усваивает данный микроэлемент, но происходит это только при наличии других компонентов, таких как фтор, йод, алюминий и хлор.
Таблица содержания брома в продуктах
| Продукт | Содержание брома на 100 г продукта |
|---|---|
| Морская капуста | 250 мкг |
| Креветки | 230 мкг |
| Треска | 230 мкг |
| Пшеница | 80 мкг |
| Ячневая крупа | 70 мкг |
| Горох | 40 мкг |
| Фасоль | 40 мкг |
| Чечевица | 40 мкг |
| Грецкие орехи | 60 мкг |
| Арахис | 60 мкг |
| Миндаль | 60 мкг |
| Фундук | 60 мкг |
| Кешью | 60 мкг |
| Нут (турецкий орех) | 40 мкг |
| Макаронные изделия | 40 мкг |
| Молоко | 30 мкг |
| Кисломолочные продукты | 20 мкг |
| Твердый сыр | 20 мкг |
| Хлеб | 40 мкг |
| Поваренная соль | 3 мкг |
БромПри температуре окружающей среды бром представляет собой коричневато-красную жидкость. Он имеет пар аналогичного цвета с неприятным удушающим запахом. Это единственный неметаллический элемент, который в обычных условиях является жидким, он легко испаряется при стандартной температуре и давлении в виде красного пара, который имеет сильный неприятный запах, напоминающий запах хлора. Бром химически менее активен, чем хлор и фтор, но более активен, чем йод; его соединения аналогичны соединениям других галогенов.Бром растворим в органических растворителях и в воде. ПримененияБром используется в промышленности для получения броморганических соединений. Основным из них был дибромэтан, агент для этилированного бензина, до того, как они были в значительной степени прекращены из-за экологических соображений. Другие броморганические соединения используются в качестве инсектицидов, в огнетушителях и в фармацевтических препаратах. Бром используется в производстве фумигантов, красителей, огнезащитных составов, составов для очистки воды, дезинфицирующих средств, лекарственных средств, агентов для фотографии и в бромированных растительных маслах, используемых в качестве эмульгатора во многих растворимых напитках со вкусом цитрусовых. Бром в окружающей средеБром - это природный элемент, который можно найти во многих неорганических веществах. Однако люди много лет назад начали внедрение органического брома в окружающую среду. Все эти соединения не являются естественными и могут нанести серьезный вред здоровью человека и окружающей среде. В диффузных породах земной коры бром естественным образом встречается в виде бромидных солей. В морской воде накопились соли брома (85 частей на миллион), из которых бром извлекается.
Вернуться к таблице Менделеева . |
|
Простая английская Википедия, бесплатная энциклопедия
Пробирка с бромом в ней. Внизу находится бром в виде жидкости, а над ним - бром в виде газа. Трубка запаяна в акриловый куб.Бром (Br) - химический элемент. Его атомный номер (то есть количество протонов в нем) - 35, а его атомный вес - 80. Он является частью элементов группы 7 (галогенов) периодической таблицы. Он двухатомный, что означает, что два атома слипаются, образуя молекулу в любом образце брома.
Физические свойства [изменить | изменить источник]
Бром - жидкость красно-коричневого цвета. Жидкие элементы встречаются редко; только бром и ртуть являются жидкими при комнатной температуре. Он легко испаряется, образуя удушающие коричневые пары. Имеет неприятный запах. Его название означает «зловоние козлов». Он может стать металлом при очень высоких давлениях.
Имеет два стабильных изотопа. Это 79 руб. И 81 руб. Есть около 29 других радиоактивных изотопов.
Химические свойства [изменить | изменить источник]
Бром довольно реакционноспособен.Его реакционная способность находится между хлором, который более реакционноспособен, и йодом, который реакционноспособен меньше. Реагирует с металлами и неметаллами. Фосфор бурно реагирует с бромом. Аналогично реагирует и алюминий. Он может отбеливать такие вещи, как хлор. Лучше реагирует на свет. Немного растворяется в воде. Горячая вода делает ее непропорциональной на бромистоводородную и бромистоводородную кислоты. Бром может образовывать соединения с такими веществами, как натрий, с образованием бромида натрия.
Химические соединения [изменить | изменить источник]
Бром образует соединения во многих степенях окисления: –1, +1, +3, +5 и (иногда) +7.–1 является наиболее распространенным. Встречается в виде бромида. Бромиды не реагируют. Это бесцветные твердые вещества, легко растворяющиеся в воде. Ковалентные бромиды могут быть жидкостями или газами. Все остальные соединения являются сильными окислителями. Их хлорные собратья встречаются чаще. +1 имеет гипобромиты, которые нестабильны. +3 имеет бромиты. Диоксид брома - единственное распространенное соединение брома, обнаруженное в степени окисления +4. +5 имеет броматы, которые встречаются чаще, чем все остальные, кроме бромидов.Броматы являются сильными окислителями и иногда добавляются в муку. +7 имеет перброматы. Перброматы очень нестабильны.
Бром находится в виде бромида в океане и в бассейнах с рассолом. В Мертвом море много бромида. Бром не является важной частью нашего тела, в отличие от его родственников хлора и йода.
Бром получают барботированием газообразного хлора через раствор бромида.Бромид окисляется до брома, а хлор восстанавливается до хлорида.
В основном используется для получения броморганических соединений, органических соединений с бромом. Броморганические соединения используются для тушения пожаров. Раньше их добавляли в бензин. Некоторые использовались как пестициды. Некоторые неорганические бромиды использовались в качестве седативных средств. Бром также можно использовать в качестве дезинфицирующего средства. Бромид серебра используется в пленке.
Бром токсичен и вызывает коррозию кожи. Газообразный бром также вызывает раздражение при вдыхании.Бром может бурно реагировать со многими вещами.
.Бром
Химический элемент бром относится к галогенам и неметаллам. Он был открыт в 1825 году Карлом Лювигом (Loewig).
Зона данных
| Классификация: | Бром - это галоген и неметалл |
| Цвет: | красно-коричневый |
| Атомный вес: | 79,904 |
| Состояние: | жидкость |
| Температура плавления: | -7 o C, 277 K |
| Температура кипения: | 58.9 o С, 332 К |
| Электронов: | 35 |
| Протонов: | 35 |
| Нейтронов в наиболее распространенном изотопе: | 44 |
| Электронные оболочки: | 2,8,18,7 |
| Электронная конфигурация: | [Ар] 3d 10 4s 2 4p 5 |
| Плотность при 20 o C: | 3,122 г / см 3 |
соединений, радиусов, проводимости
| Атомный объем: | 23.5 см 3 / моль |
| Состав: | слоев Br 2 |
| Твердость: | |
| Удельная теплоемкость | 0,473 Дж г -1 К -1 |
| Теплота плавления | 10,57 кДж моль -1 Br 2 |
| Теплота распыления | 112 кДж моль -1 |
| Теплота испарения | 29.96 кДж моль -1 Br 2 |
| 1 st энергия ионизации | 1139,9 кДж моль -1 |
| 2 nd энергия ионизации | 2103,4 кДж моль -1 |
| 3 rd энергия ионизации | 3473,4 кДж моль -1 |
| Сродство к электрону | 324,7 кДж моль -1 |
| Минимальная степень окисления | –1 |
| Мин.общее окисление нет. | –1 |
| Максимальное число окисления | 7 |
| Макс. общее окисление нет. | 5 |
| Электроотрицательность (шкала Полинга) | 2,96 |
| Объем поляризуемости | 3,1 Å 3 |
| Реакция с воздухом | нет |
| Реакция с 15 M HNO 3 | – |
| Реакция с 6 M HCl | нет, растворяет Br 2 (водн.) |
| Реакция с 6 М NaOH | легкая, ⇒ ОБр - , Бр - |
| Оксид (оксиды) | Br 2 O, BrO 2 |
| Гидрид (-ы) | HBr |
| Хлорид (ы) | BrCl |
| Атомный радиус | 115 вечера |
| Ионный радиус (1+ ион) | – |
| Ионный радиус (2+ ионов) | – |
| Ионный радиус (3+ ионов) | – |
| Ионный радиус (1-ионный) | 182 вечера |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 0.12 Вт м -1 K -1 |
| Электропроводность | 1,0 x 10 -10 См -1 |
| Температура замерзания / плавления: | -7 o C, 277 K |
Бром в пробирке. (Фото Greenhorn1)
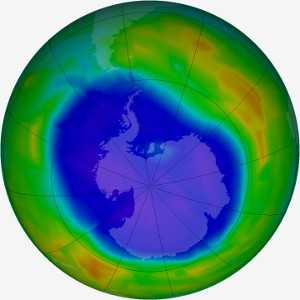
Разрушение озонового слоя над Антарктидой: интенсивность синего цвета показывает серьезность истощения озонового слоя над Антарктидой в сентябре 2011 года. Атом за атомом, атомы брома в 40-100 раз более разрушительны в озоновом слое, чем атомы хлора.Реакции с участием брома ответственны за до половины потерь озона над Антарктидой. Самым крупным источником озоноразрушающего брома является бромистый метил. В основном бромистый метил используется в качестве фумиганта. Около 30% брома в атмосфере образуется в результате деятельности человека, остальное - естественного происхождения. (7) Фото: Наблюдение за озоновой дырой НАСА.
Активная реакция между бромом и алюминием.
Как бром используется для различения насыщенных и ненасыщенных углеводородов.
Открытие брома
Доктор Дуг Стюарт
Соединения брома использовались с древних времен.
В первом веке нашей эры римский автор Плиний описал одну из первых в мире химических производств: фабрики по производству красителей, производящие тирский пурпур. Тирийский пурпур (или королевский пурпур) - это древний пурпурный краситель, получаемый из морского моллюска. Основным компонентом красителя является соединение брома 6,6'-диброминдиго. (1)
Три человека сыграли важную роль в открытии элемента брома.
Сначала немецкий химик Юстус фон Либих, один из самых известных химиков своего времени. Либиху можно было бы приписать независимое открытие брома, но он упустил возможность. В 1825 году соледователь отправил Либиху образец соленой воды из немецкого города Бад-Кройцнах с просьбой провести анализ.
Образец содержал относительно большое количество брома, выделенного Либихом. Не рассматривая это вещество слишком серьезно, он пришел к выводу, что это соединение йода и хлора.
Только после того, как было объявлено о существовании брома, мучительный Либих вернулся к красно-коричневой жидкости, чтобы внимательно ее изучить.
Затем он поместил бутылку в свой «шкаф для ошибок», чтобы напомнить себе, что предвзятые идеи разрушили его шанс открыть новый элемент и попытаться не повторить ту же ошибку снова. (2), (3), (4), (5)
Следующее имя в истории брома - Карл Лювиг (Loewig), который открыл бром в 1825 году, еще будучи студентом химии в Гейдельбергском университете, Германия.
Родным городом Лювига был Бад-Кройцнах, откуда был взят образец Либиха. Лювиг взял воду из соленого источника
.Что такое бром?
Что такое бром? Происхождение / значение названия Bromine
Название происходит от греческого слова Bromos, означающего «зловоние» из-за сильного неприятного запаха.
Что такое бром? Группа Периодической таблицы и классификация элемента брома
Элементы могут быть классифицированы на основе их физических состояний (состояний вещества), например газ, твердое тело или жидкость. Этот элемент является жидкостью при комнатной температуре. Бром классифицируется как элемент в разделе «Галогены», который может находиться в группе 7 Периодической таблицы.Термин «галоген» означает «солеобразователь», а соединения, содержащие галогены, называются «солями». Галогены существуют при комнатной температуре во всех трех состояниях вещества - газах, таких как фтор и хлор, твердых веществах, таких как йод и астат, и жидкости, например, в броме.
Что такое бром? Факты об открытии и История элемента брома
Бром был открыт Антуаном Ж. Баларом во Франции в 1826 году, который выделил его из морской соли. Он назвал его бромом (зловоние) из-за невыносимых паров.
Что такое бром? Наличие элемента брома
Бром почти полностью встречается в форме бромидов, особенно в виде бромида натрия и бромида магния, которые обнаружены во многих соляных источниках и соляных отложениях. Месторождения Штассфурт в Германии и соленые воды Огайо и Мичигана особенно богаты бромидами. Бром встречается в природе в виде солей бромида в морской воде
Основные продуценты - США и Израиль
Содержание элемента в различных средах
% во Вселенной 710 -7 %
% в Солнце Н / Д
% в Метеоритах 0 .00012%
% в земной коре 0,0003%
% в океанах 0,0067%
% в организме человека 0,00029%
Медицинское использование брома - здоровье и лечение
Интересная информация о медицинском использовании брома, здоровье и лечении. Бром широко используется в производстве многих фармацевтических препаратов. Соединения брома использовались как седативные, снотворные и анальгетические средства.
Сопутствующие виды использования брома
Бензиновые антидетонационные смеси
Фумиганты
Яды
Красители
Фотографические химикаты
Лекарства
Бромированное растительное масло











